网址:http://m.1010jiajiao.com/timu3_id_60387[举报]
(1)在当代人们的生活中,你所知道的利用太阳能辐射加热物体的方式有
(2)在生物质能的利用过程中,可以制得重要的有机物乙醇.某校化学课外兴趣小组的学生为了验证乙醇的分子结构,设计如下实验程序:乙醇的组成元素的确定、分子式的确定、分子结构的确定.
(Ⅰ)他们决定用分析乙醇燃烧的产物来确定乙醇中含有C、H两种元素,简要说明他们的实验操作方法和现象:
①证明含有氢元素的实验操作方法和现象是
②证明含有碳元素的实验操作方法和现象是
(Ⅱ)用分析燃烧产物来证实乙醇中还含有氧元素时,需要取得一些实验数据,这些数据应该是
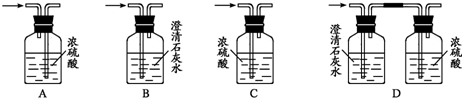
实验中他们可能会用到下列装置,请你将必需的相关装置的序号按从左到右排出合理的顺序(→表示气体的流向):
(Ⅲ)为确定乙醇的分子式,除(Ⅱ)中需要取得的数据外,你认为还是否需要测定乙醇的相对分子质量呢?
(Ⅳ)为确定乙醇的分子结构,他们先测定一定量无水乙醇和金属钠反应生成氢气的体积,选用了如下图所示的仪器装置(有的仪器配有双孔橡皮塞).则

①这些仪器装置的合理的连接顺序是
②由实验证明乙醇的分子结构是CH3CH2OH而不是CH3OCH3的理由是
(3)开发新能源以缓解石油等的短缺引起的能源危机是一个重要课题.据报道,某地近年建设了一个年生产工业酒精500万吨的工厂,目的是为了将工业酒精与汽油混合作为汽车燃料而减少汽油的消耗量.已知生产酒精的方法有如下三种(用化学方程式表示):
方法一:CH2=CH2+H2O
| ||
| △ |
方法二:CH3-CH2Br+H2O
| ||
| △ |
方法三:(C6H10O5)n(淀粉)+n H2O
| 淀粉酶 |
C6H12O6(葡萄糖)
| 酒化酶 |
综合地看,你认为这三种方法中,较好的是
A.方法一 B.方法二 C.方法三
你认为该工厂生产工业酒精用的是
(1)实验中除了托盘天平(带砝码)、烧杯、玻璃棒、胶头滴管、药匙外,还需要的仪器有
(2)根据计算得知,需称取NaOH固体的质量为
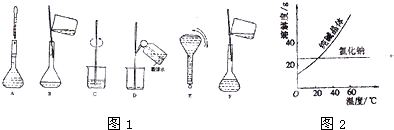
(3)配制过程中有几个关键的步骤和操作如图1所示,将实验步骤A-F按实验过程先后次序排列
(4)配制一定物质的量浓度溶液的实验中,下列操作会导致溶液浓度偏高的是
A.在托盘天平的两托盘中分别放等质量的纸,称取NaOH固体
B.将NaOH固体在烧杯中溶解后迅速小心转移至容量瓶中
C.定容时不小心加水超过了刻度线,此时迅速用胶头滴管吸出一些
D.定容时仰视容量瓶刻度线
Ⅱ.阅读、分析下列两个材料:
材料一:如图2
材料二:
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g?cm-3 | 溶解性 | 乙二醇C2H6O2 | -11.5 | 198 | 1.11 | 易溶于水和乙醇 | 丙三醇C3H8O3 | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比互溶 |
A.蒸馏法B.萃取法C.“溶解、结晶、过滤”的方法D.分液法
(1)将纯碱从氯化钠和纯碱的混合物中分离出来,最好应用
(2)将乙二醇和丙三醇相互分离的最佳方法是
Ⅲ.有一固体粉末,其中可能含有Na2CO3、NaCl、Na2SO4、CuCl2、Ba(NO3)2、K2CO3中的一种或几种,现按下列步骤进行实验.
(1)将该粉末溶于水得无色溶液和白色沉淀.
(2)在滤出的沉淀中加入稀硝酸,有部分沉淀溶解,同时产生无色气体.
(3)取滤液做焰色反应,火焰呈黄色,透过蓝色的钴玻璃观察,未见火焰呈紫色.由上述现象推断:该混合物中一定含有
 (2009?合肥三模)A、B、C、D、E是中学常见的单质,X是化合物.A为金属,原子最外层p轨道上只有一个电子,可与NaOH溶液反应;B是常见的金属,其基态原子的外围电子排布式为3d64s2;常温下C是气态非金属单质,可以燃烧;D是空气主要成分之一,可与C发生重要工业反应生成X;E是固体非金属单质,在氧气中燃烧时有明亮的蓝紫色火焰.根据上述物质的信息,回答下列有关问题:
(2009?合肥三模)A、B、C、D、E是中学常见的单质,X是化合物.A为金属,原子最外层p轨道上只有一个电子,可与NaOH溶液反应;B是常见的金属,其基态原子的外围电子排布式为3d64s2;常温下C是气态非金属单质,可以燃烧;D是空气主要成分之一,可与C发生重要工业反应生成X;E是固体非金属单质,在氧气中燃烧时有明亮的蓝紫色火焰.根据上述物质的信息,回答下列有关问题:(1)写出单质B与Cl2的反应产物与X的水溶液反应的离子方程式:
(2)已知单质E的燃烧热为296.8kJ/mol,写出表示E燃烧热的热化学方程式:
(3)写出A的氧化物与NaOH溶液反应的离子方程式:
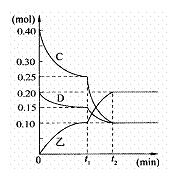
(4)将0.40molC和0.20molD充入2L的密闭容器中,在一定条件下反应生成X,有关C、D、X三者的物质的量的变化与时间的关系如图所示:
①若t1=10min 则0~t1时间内C物质的平均反应速率为
| c2(NH3) |
| c(N2)?c3(H2) |
| c2(NH3) |
| c(N2)?c3(H2) |
②该反应在t2时达到平衡,根据图中曲线变化情况判断,t1时刻改变的反应条件可能是
a.加入了催化剂 b.降低了反应温度 c.向容器中又充入了气体D.
假如你是一位企业家,在众多开发海水资源的项目中,选择了海水提镁,在前期考察过程中你将遇到许多问题,请根据背景材料的提示,按要求完成相关问题:
背景材料1:下面所示为海水中各元素含量情况(mg/L)
|
元素 |
浓度(mg/L) |
元素 |
浓度(mg/L) |
|
钠 |
10 770 |
氯 |
19 350 |
|
镁 |
1 290 |
硫 |
885 |
|
钾 |
380 |
溴 |
67 |
|
钙 |
400 |
碘 |
0.06 |
背景材料2:部分化学试剂的市场价格
|
试剂 |
氢氧化钾 |
氢氧化钠 |
氢氧化钙 |
氧化钙 |
|
价格(元/吨) |
5 238.00 |
2 300.00 |
1 200.00 |
700.00 |
请完成下列问题:
(1)在海水提镁的过程中要实现对镁离子的富集、分离,有以下三个方案:
方案一:直接往海水中加入沉淀剂;
方案二:加热蒸发海水再加入沉淀剂;
方案三:在晒盐后的卤水中加入沉淀剂。
你认为方案________最合理。
不选方案________的理由是________________________________________________
不选方案________的理由是_______________________________________________
(2)应该选择________试剂作为镁离子的沉淀剂。不考虑其他费用,沉淀相同量的镁离子所用氢氧化钠和氧化钙的价格比为________。
(3)为了节省成本,考虑以海边上的贝壳为原料,试简述其理由__________________________
查看习题详情和答案>>
已知A、B为常见的金属单质,C、D为常见的非金属单质,甲、乙、丙为三种常见的化合物,它们之间的相互转化关系如下图所示(部分产物及反应条件没有列出):
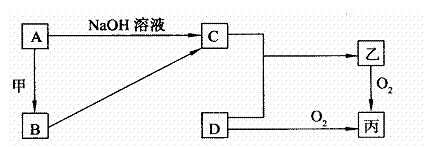
(1)若甲是中学化学中常见的红棕色粉末状固体,则单质A与NaOH溶液反应的离子方程式为 ;B在潮湿的空气中易发生电化学腐蚀,写出其发生电化学腐蚀时原电池负极的电极反应式: 。
(2)若乙在水溶液呈弱酸性,丙是一种大气污染物,有刺激性气味。试写出乙在水溶液中发生电离时的电离方程式 ;已知16g固体单质D完全燃烧转化成乙时,放出148.4kJ的热量,则该反应的热化学方程式为 。
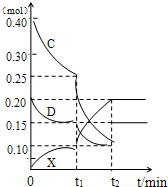
(3)若乙在水溶液呈弱碱性,并可用作农业化肥,D常况下为气体,则进行下列研究: 现将0.40 mol C和0.20 mol D充入10L的密闭容器中,在一定条件下使其发生反应,有关C、D、乙三者的物质的量的变化与时间的关系如右图所示:
①若t1 = 10min,则0至t1时间内C物质的平均反应速率为 ;该反应在t2时达到平衡,其化学反应方程式为 ,此温度下的该反应的平衡常数为 。
②根据图中曲线变化情况判断,t1时刻改变的反应条件可能是 (填下列各项序号)
a.加入了催化剂
b.降低了反应的温度
c.向容器中又充入了气体D