题目内容
Ⅰ.实验室使用容量瓶来配制一定体积、一定浓度的溶液.现在实验室需要0.10mol?L-1NaOH溶液450mL,根据溶液配制中的情况回答下列问题:
(1)实验中除了托盘天平(带砝码)、烧杯、玻璃棒、胶头滴管、药匙外,还需要的仪器有
(2)根据计算得知,需称取NaOH固体的质量为
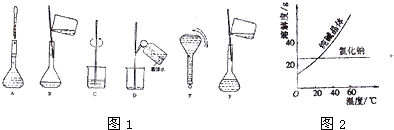
(3)配制过程中有几个关键的步骤和操作如图1所示,将实验步骤A-F按实验过程先后次序排列
(4)配制一定物质的量浓度溶液的实验中,下列操作会导致溶液浓度偏高的是
A.在托盘天平的两托盘中分别放等质量的纸,称取NaOH固体
B.将NaOH固体在烧杯中溶解后迅速小心转移至容量瓶中
C.定容时不小心加水超过了刻度线,此时迅速用胶头滴管吸出一些
D.定容时仰视容量瓶刻度线
Ⅱ.阅读、分析下列两个材料:
材料一:如图2
材料二:
根据上述材料及课本知识,回答下列问题(填写序号):
A.蒸馏法B.萃取法C.“溶解、结晶、过滤”的方法D.分液法
(1)将纯碱从氯化钠和纯碱的混合物中分离出来,最好应用
(2)将乙二醇和丙三醇相互分离的最佳方法是
Ⅲ.有一固体粉末,其中可能含有Na2CO3、NaCl、Na2SO4、CuCl2、Ba(NO3)2、K2CO3中的一种或几种,现按下列步骤进行实验.
(1)将该粉末溶于水得无色溶液和白色沉淀.
(2)在滤出的沉淀中加入稀硝酸,有部分沉淀溶解,同时产生无色气体.
(3)取滤液做焰色反应,火焰呈黄色,透过蓝色的钴玻璃观察,未见火焰呈紫色.由上述现象推断:该混合物中一定含有
(1)实验中除了托盘天平(带砝码)、烧杯、玻璃棒、胶头滴管、药匙外,还需要的仪器有
500mL容量瓶
500mL容量瓶
.(2)根据计算得知,需称取NaOH固体的质量为
2.0
2.0
g.(3)配制过程中有几个关键的步骤和操作如图1所示,将实验步骤A-F按实验过程先后次序排列
CBDFAE
CBDFAE
.
(4)配制一定物质的量浓度溶液的实验中,下列操作会导致溶液浓度偏高的是
B
B
.A.在托盘天平的两托盘中分别放等质量的纸,称取NaOH固体
B.将NaOH固体在烧杯中溶解后迅速小心转移至容量瓶中
C.定容时不小心加水超过了刻度线,此时迅速用胶头滴管吸出一些
D.定容时仰视容量瓶刻度线
Ⅱ.阅读、分析下列两个材料:
材料一:如图2
材料二:
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g?cm-3 | 溶解性 | 乙二醇C2H6O2 | -11.5 | 198 | 1.11 | 易溶于水和乙醇 | 丙三醇C3H8O3 | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比互溶 |
A.蒸馏法B.萃取法C.“溶解、结晶、过滤”的方法D.分液法
(1)将纯碱从氯化钠和纯碱的混合物中分离出来,最好应用
C
C
;(2)将乙二醇和丙三醇相互分离的最佳方法是
A
A
.Ⅲ.有一固体粉末,其中可能含有Na2CO3、NaCl、Na2SO4、CuCl2、Ba(NO3)2、K2CO3中的一种或几种,现按下列步骤进行实验.
(1)将该粉末溶于水得无色溶液和白色沉淀.
(2)在滤出的沉淀中加入稀硝酸,有部分沉淀溶解,同时产生无色气体.
(3)取滤液做焰色反应,火焰呈黄色,透过蓝色的钴玻璃观察,未见火焰呈紫色.由上述现象推断:该混合物中一定含有
Na2CO3、Na2SO4、Ba(NO3)2
Na2CO3、Na2SO4、Ba(NO3)2
;一定不含有CuCl2、K2CO3
CuCl2、K2CO3
;可能含有NaCl
NaCl
.分析:Ⅰ.配制450mL溶液,实验室没有该规格的容量瓶,需要选用500mL容量瓶,
(1)根据配制一定物质的量浓度的溶液使用的仪器完成;
(2)根据配制500mL 0.10mol?L-1NaOH溶液中含有的氢氧化钠的物质的量计算出氢氧化钠的质量;
(3)根据配制一定物质的量浓度的溶液的配制步骤进行排序;
(4)根据cB=
可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量nB和溶液的体积V引起的,若nB比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若nB比理论值大,或V比理论值小时,都会使所配溶液浓度偏大;
Ⅱ.(1)根据图2中氯化钠和碳酸钠在溶液中的溶解度受温度影响大小选择分离方法;
(2)根据表中数据可知,乙二醇和丙三醇的沸点相差较大;
Ⅱ.(1)根据得到无色溶液和白色沉淀,有色离子不能存在;
(2)加入稀硝酸,有部分沉淀溶解,不溶解的一定是硫酸钡,溶解的为碳酸钡;同时产生无色气体,说明溶液中含有碳酸根离子;
(3)焰色反应为黄色,一定存在钠离子,透过蓝色的钴玻璃观察,未见火焰呈紫色,一定没有钾离子.
(1)根据配制一定物质的量浓度的溶液使用的仪器完成;
(2)根据配制500mL 0.10mol?L-1NaOH溶液中含有的氢氧化钠的物质的量计算出氢氧化钠的质量;
(3)根据配制一定物质的量浓度的溶液的配制步骤进行排序;
(4)根据cB=
| nB |
| V |
Ⅱ.(1)根据图2中氯化钠和碳酸钠在溶液中的溶解度受温度影响大小选择分离方法;
(2)根据表中数据可知,乙二醇和丙三醇的沸点相差较大;
Ⅱ.(1)根据得到无色溶液和白色沉淀,有色离子不能存在;
(2)加入稀硝酸,有部分沉淀溶解,不溶解的一定是硫酸钡,溶解的为碳酸钡;同时产生无色气体,说明溶液中含有碳酸根离子;
(3)焰色反应为黄色,一定存在钠离子,透过蓝色的钴玻璃观察,未见火焰呈紫色,一定没有钾离子.
解答:解:Ⅰ.实验室没有450mL的容量瓶,需要选用500mL容量瓶配制溶液,
(1)配制一定物质的量浓度的溶液使用的仪器有:托盘天平(带砝码)、烧杯、玻璃棒、胶头滴管、药匙、500mL容量瓶,
故答案为:500mL容量瓶;
(2)配制0.10mol?L-1NaOH溶液500mL,需要氢氧化钠的物质的量为:0.10mol?L-1×0.5L=0.05mol,氢氧化钠的质量为:40g/mol×0.05mol=2.0g,
故答案为:2.0(有效数字1分)
(3)配制一定物质的量浓度的溶液的步骤为:计算、称量、溶解、冷却、转移、洗涤、定容、摇匀等,实验步骤A-F按实验过程先后次序为:CBDFAE,
故答案为:CBDFAE(一个次序错全错);
(4)A.在托盘天平的两托盘中分别放等质量的纸,称取NaOH固体,导致氢氧化钠潮解,称量的氢氧化钠的质量偏小,配制的溶液中氢氧化钠的物质的量偏小,根据cB=
可得,溶液的浓度偏低,故A错误;
B.将NaOH固体在烧杯中溶解后迅速小心转移至容量瓶中,热的溶液体积偏大,冷却后溶液体积减小,根据cB=
可得,配制的溶液浓度偏高,故B正确;
C.定容时不小心加水超过了刻度线,导致配制的溶液体积偏大,根据cB=
可得,溶液浓度偏低,故C错误
D.定容时仰视容量瓶刻度线,导致加入的蒸馏水体积偏大,根据cB=
可得,配制的溶液浓度偏低,故D错误;
故选B;
Ⅱ.(1)根据图2可知,氯化钠溶解度受温度影响较小,碳酸钠的溶解度受温度影响较大,可以通过“溶解、结晶、过滤”方法分离,
故选C;
(2)根据表中数据可知,乙二醇和丙三醇的沸点相差较大,可以通过蒸馏方法分离,
故选A;
Ⅲ.1)将该粉末溶于水得无色溶液和白色沉淀,CuCl2溶液为蓝色,所以一定没有CuCl2,
(2)在滤出的沉淀中加入稀硝酸,有部分沉淀溶解,溶解的沉淀为碳酸钡,不溶解的沉淀为硫酸钡,说明一定含有Na2SO4、Ba(NO3)2,Na2CO3和K2CO3至少含有一种;同时产生无色气体,无色气体为二氧化碳;
(3)取滤液做焰色反应,火焰呈黄色,说明一定含有Na2CO3;透过蓝色的钴玻璃观察,未见火焰呈紫色,一定不含K2CO3,
由上述现象推断:该混合物中一定含有:Na2CO3、Na2SO4、Ba(NO3)2;一定不含有CuCl2、K2CO3;可能含有 NaCl,
故答案为:Na2CO3、Na2SO4、Ba(NO3)2;CuCl2、K2CO3;NaCl.
(1)配制一定物质的量浓度的溶液使用的仪器有:托盘天平(带砝码)、烧杯、玻璃棒、胶头滴管、药匙、500mL容量瓶,
故答案为:500mL容量瓶;
(2)配制0.10mol?L-1NaOH溶液500mL,需要氢氧化钠的物质的量为:0.10mol?L-1×0.5L=0.05mol,氢氧化钠的质量为:40g/mol×0.05mol=2.0g,
故答案为:2.0(有效数字1分)
(3)配制一定物质的量浓度的溶液的步骤为:计算、称量、溶解、冷却、转移、洗涤、定容、摇匀等,实验步骤A-F按实验过程先后次序为:CBDFAE,
故答案为:CBDFAE(一个次序错全错);
(4)A.在托盘天平的两托盘中分别放等质量的纸,称取NaOH固体,导致氢氧化钠潮解,称量的氢氧化钠的质量偏小,配制的溶液中氢氧化钠的物质的量偏小,根据cB=
| nB |
| V |
B.将NaOH固体在烧杯中溶解后迅速小心转移至容量瓶中,热的溶液体积偏大,冷却后溶液体积减小,根据cB=
| nB |
| V |
C.定容时不小心加水超过了刻度线,导致配制的溶液体积偏大,根据cB=
| nB |
| V |
D.定容时仰视容量瓶刻度线,导致加入的蒸馏水体积偏大,根据cB=
| nB |
| V |
故选B;
Ⅱ.(1)根据图2可知,氯化钠溶解度受温度影响较小,碳酸钠的溶解度受温度影响较大,可以通过“溶解、结晶、过滤”方法分离,
故选C;
(2)根据表中数据可知,乙二醇和丙三醇的沸点相差较大,可以通过蒸馏方法分离,
故选A;
Ⅲ.1)将该粉末溶于水得无色溶液和白色沉淀,CuCl2溶液为蓝色,所以一定没有CuCl2,
(2)在滤出的沉淀中加入稀硝酸,有部分沉淀溶解,溶解的沉淀为碳酸钡,不溶解的沉淀为硫酸钡,说明一定含有Na2SO4、Ba(NO3)2,Na2CO3和K2CO3至少含有一种;同时产生无色气体,无色气体为二氧化碳;
(3)取滤液做焰色反应,火焰呈黄色,说明一定含有Na2CO3;透过蓝色的钴玻璃观察,未见火焰呈紫色,一定不含K2CO3,
由上述现象推断:该混合物中一定含有:Na2CO3、Na2SO4、Ba(NO3)2;一定不含有CuCl2、K2CO3;可能含有 NaCl,
故答案为:Na2CO3、Na2SO4、Ba(NO3)2;CuCl2、K2CO3;NaCl.
点评:本题考查了配制一定物质的量浓度的溶液的方法、离子推断、物质的分离与提纯,题目难度中等,试题基础性强,贴近高考,注重灵活性,侧重对学生能力的培养和解题方法的指导和训练,有利于培养学生的逻辑思维能力和严谨的规范实验操作能力;该题的难点在于误差分析,根据nB=
可得,误差分析时关键要看配制过程中引起nB和V怎样的变化.
| nB |
| V |

练习册系列答案
相关题目
 实验室用固体NaOH配制0.5mol/L的NaOH溶液500mL,有以下仪器和用品有:①烧杯 ②100mL量筒 ③500mL容量瓶 ④药匙 ⑤玻璃棒 ⑥托盘天平(带砝码)
实验室用固体NaOH配制0.5mol/L的NaOH溶液500mL,有以下仪器和用品有:①烧杯 ②100mL量筒 ③500mL容量瓶 ④药匙 ⑤玻璃棒 ⑥托盘天平(带砝码)