题目内容
 (2009?合肥三模)A、B、C、D、E是中学常见的单质,X是化合物.A为金属,原子最外层p轨道上只有一个电子,可与NaOH溶液反应;B是常见的金属,其基态原子的外围电子排布式为3d64s2;常温下C是气态非金属单质,可以燃烧;D是空气主要成分之一,可与C发生重要工业反应生成X;E是固体非金属单质,在氧气中燃烧时有明亮的蓝紫色火焰.根据上述物质的信息,回答下列有关问题:
(2009?合肥三模)A、B、C、D、E是中学常见的单质,X是化合物.A为金属,原子最外层p轨道上只有一个电子,可与NaOH溶液反应;B是常见的金属,其基态原子的外围电子排布式为3d64s2;常温下C是气态非金属单质,可以燃烧;D是空气主要成分之一,可与C发生重要工业反应生成X;E是固体非金属单质,在氧气中燃烧时有明亮的蓝紫色火焰.根据上述物质的信息,回答下列有关问题:(1)写出单质B与Cl2的反应产物与X的水溶液反应的离子方程式:
Fe3++3NH3?H2O═Fe(OH)3↓+3NH4+
Fe3++3NH3?H2O═Fe(OH)3↓+3NH4+
.B单质在海水中易发生电化学腐蚀,写出电化学腐蚀的正极电极方程式:O2+2H2O+4e-═4OH-
O2+2H2O+4e-═4OH-
.(2)已知单质E的燃烧热为296.8kJ/mol,写出表示E燃烧热的热化学方程式:
S(g)+O2(g)═SO2(g);△H=-296.8kJ/mol
S(g)+O2(g)═SO2(g);△H=-296.8kJ/mol
.(3)写出A的氧化物与NaOH溶液反应的离子方程式:
Al2O3+2OH-═2AlO2-+H2O
Al2O3+2OH-═2AlO2-+H2O
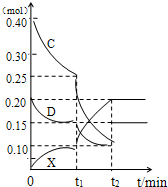
.(4)将0.40molC和0.20molD充入2L的密闭容器中,在一定条件下反应生成X,有关C、D、X三者的物质的量的变化与时间的关系如图所示:
①若t1=10min 则0~t1时间内C物质的平均反应速率为
0.0075mol/(L?min)
0.0075mol/(L?min)
;该反应平衡常数表达式为| c2(NH3) |
| c(N2)?c3(H2) |
| c2(NH3) |
| c(N2)?c3(H2) |
②该反应在t2时达到平衡,根据图中曲线变化情况判断,t1时刻改变的反应条件可能是
a
a
(填序号)a.加入了催化剂 b.降低了反应温度 c.向容器中又充入了气体D.
分析:A、B、C、D、E是中学常见的单质,X是化合物.A为金属,原子最外层p轨道上只有一个电子,则A处于第ⅢA族,可与NaOH溶液反应,故A为铝;B是常见的金属,其基态原子的外围电子排布式为3d64s2,原子电子排布式为1s22s22p63s23p63d64s2,是26号元素,则B为铁;E是固体非金属单质,在氧气中燃烧时有明亮的蓝紫色火焰,则E为硫;常温下C是气态非金属单质,可以燃烧,则C为氢气;D是空气主要成分之一,可与C发生重要工业反应生成X,则D为氮气,X为氨气.
解答:解:A、B、C、D、E是中学常见的单质,X是化合物.A为金属,原子最外层p轨道上只有一个电子,则A处于第ⅢA族,可与NaOH溶液反应,故A为铝;B是常见的金属,其基态原子的外围电子排布式为3d64s2,原子电子排布式为1s22s22p63s23p63d64s2,是26号元素,则B为铁;E是固体非金属单质,在氧气中燃烧时有明亮的蓝紫色火焰,则E为硫;常温下C是气态非金属单质,可以燃烧,则C为氢气;D是空气主要成分之一,可与C发生重要工业反应生成X,则D为氮气,X为氨气.
故A为铝;B为铁;C为氢气;D为氮气,E为硫;X为氨气.
(1)铁与氯气反应生成氯化铁,氯化铁与氨水反应生成氢氧化铁沉淀与氯化铵,反应离子方程式为Fe3++3NH3?H2O═Fe(OH)3↓+3NH4+.铁在海水中发生吸氧腐蚀,原电池正极发生还原反应,氧气在正极放电,电化学腐蚀的正极电极方程式为O2+2H2O+4e-═4OH-.
故答案为:Fe3++3NH3?H2O═Fe(OH)3↓+3NH4+;O2+2H2O+4e-═4OH-.
(2)S的燃烧热为296.8kJ/mol,硫燃烧热的热化学方程式为S(g)+O2(g)═SO2(g);△H=-296.8kJ/mol.
故答案为:S(g)+O2(g)═SO2(g);△H=-296.8kJ/mol.
(3)氧化铝与氢氧化钠溶液反应,生成偏铝酸钠与水,反应的离子方程式为Al2O3+2OH-═2AlO2-+H2O.
故答案为:Al2O3+2OH-═2AlO2-+H2O.
(4)将0.40molC和0.20molD充入2L的密闭容器中,在一定条件下反应生成X,有关C、D、X三者的物质的量的变化与时间的关系如图所示:
①由图可知,10min内C的物质的量变化为0.4mol-0.25mol=0.15mol,所以v(C)=
=0.0075mol/(L?min),
该反应方程式为N2+3H2?2NH3,该反应平衡常数表达式为k=
.
故答案为:0.0075mol/(L?min);
.
②由图可知t1时刻瞬间反应混合物的物质的量不变,随后C、D较小,X增加,反应向正反应进行,单位时间内反应混合物的物质的量变化更大,该反应为体积减小的放热反应.
a.加入了催化剂,瞬间反应混合物的物质的量不变,反应速率加快,故a正确;
b.降低了反应温度,反应速率降低,单位时间内反应混合物的物质的量变化减小,故b错误;
c.向容器中又充入了气体D,瞬间D的物质的量应该增大,瞬间反应混合物的物质的量不变,故c错误.
故选:a.
故A为铝;B为铁;C为氢气;D为氮气,E为硫;X为氨气.
(1)铁与氯气反应生成氯化铁,氯化铁与氨水反应生成氢氧化铁沉淀与氯化铵,反应离子方程式为Fe3++3NH3?H2O═Fe(OH)3↓+3NH4+.铁在海水中发生吸氧腐蚀,原电池正极发生还原反应,氧气在正极放电,电化学腐蚀的正极电极方程式为O2+2H2O+4e-═4OH-.
故答案为:Fe3++3NH3?H2O═Fe(OH)3↓+3NH4+;O2+2H2O+4e-═4OH-.
(2)S的燃烧热为296.8kJ/mol,硫燃烧热的热化学方程式为S(g)+O2(g)═SO2(g);△H=-296.8kJ/mol.
故答案为:S(g)+O2(g)═SO2(g);△H=-296.8kJ/mol.
(3)氧化铝与氢氧化钠溶液反应,生成偏铝酸钠与水,反应的离子方程式为Al2O3+2OH-═2AlO2-+H2O.
故答案为:Al2O3+2OH-═2AlO2-+H2O.
(4)将0.40molC和0.20molD充入2L的密闭容器中,在一定条件下反应生成X,有关C、D、X三者的物质的量的变化与时间的关系如图所示:
①由图可知,10min内C的物质的量变化为0.4mol-0.25mol=0.15mol,所以v(C)=
| ||
| 10min |
该反应方程式为N2+3H2?2NH3,该反应平衡常数表达式为k=
| c2(NH3) |
| c(N2)?c3(H2) |
故答案为:0.0075mol/(L?min);
| c2(NH3) |
| c(N2)?c3(H2) |
②由图可知t1时刻瞬间反应混合物的物质的量不变,随后C、D较小,X增加,反应向正反应进行,单位时间内反应混合物的物质的量变化更大,该反应为体积减小的放热反应.
a.加入了催化剂,瞬间反应混合物的物质的量不变,反应速率加快,故a正确;
b.降低了反应温度,反应速率降低,单位时间内反应混合物的物质的量变化减小,故b错误;
c.向容器中又充入了气体D,瞬间D的物质的量应该增大,瞬间反应混合物的物质的量不变,故c错误.
故选:a.
点评:考查元素化合物推断、热化学反应方程式、原电池、化学平衡等,难度中等,推断化合物是关键,需对元素化合物知识熟练掌握.注意(2)中燃烧热的热化学反应方程式书写,可燃物为1mol;(4)②t1时刻未达平衡.

练习册系列答案
相关题目