摘要:在Al(OH)3.Al2O3.NaHCO3.H2N-CH2-COOH.(NH4)2S.NaHSO4等物质中.既能与盐酸反应又能与氢氧化钠反应的有 A.3种 B.4种 C.5种 D.6种
网址:http://m.1010jiajiao.com/timu3_id_52653[举报]
(2012?河西区一模)下图中D、E、Z是单质,其余均是化合物.且知D、E为日常常用金属;D元素的原子最外层电子数与电子层数相等{无色气体N在Z中燃烧生成气体X;N、Z、Y是氯碱工业的产品;除反应①外,其他反应均在水溶液中进行.

请按要求回答下列问题:
(1)D在周期表中的位置:
 .
.
(2)G可做净水剂助剂,能加快悬浮物固体的沉降,请用离子方程式表示其原因:
(3)写出反应①的化学方程式:
(4)上图反应中不属于氧化还原反应的是(填编号)
(5)向含有0.2mol A和0.2mol X的混合溶液中,逐渐加入E粉末至过量(假设E与A完全反应后,再与X反应).请在坐标系中画出n(B)随n(E)变化的示意图:

查看习题详情和答案>>

请按要求回答下列问题:
(1)D在周期表中的位置:
第三周期,第ⅢA族
第三周期,第ⅢA族
;X的电子式为

(2)G可做净水剂助剂,能加快悬浮物固体的沉降,请用离子方程式表示其原因:
AlO2-+2H2O=Al(OH)3胶体+OH-
AlO2-+2H2O=Al(OH)3胶体+OH-
.(3)写出反应①的化学方程式:
2Al+3FeO
Al2O3+3Fe
| ||
2Al+3FeO
Al2O3+3Fe
.在B溶液中滴加黄色K3[Fe(CN)6]溶液,可观察到的现象是
| ||
生成有特征蓝色的沉淀
生成有特征蓝色的沉淀
.(4)上图反应中不属于氧化还原反应的是(填编号)
④⑦⑧⑨
④⑦⑧⑨
.(5)向含有0.2mol A和0.2mol X的混合溶液中,逐渐加入E粉末至过量(假设E与A完全反应后,再与X反应).请在坐标系中画出n(B)随n(E)变化的示意图:

 新型陶瓷氮化铝可用Al2O3高温还原法制备:Al2O3+3C+N
新型陶瓷氮化铝可用Al2O3高温还原法制备:Al2O3+3C+N
| ||
(1)从原料角度分析,AlN中的杂质可能是
(2)装置B中的试剂是
(3)充分反应后,需打开K通入一段时间N2,其目的是
(4)下列针对该实验的各项措施中,不能提高测定结果准确度的是
a.在加入NaOH溶液之前,排净装置内的氧气
b.滴加NaOH溶液不宜过快
c.取消B装置
d.在C之后增添盛有碱石灰的干燥管
(5)实验中准确称取m g的样品三份,进行三次测定,测得实验前后装置C平均增重n g,则样品中AlN的纯度为
(6)实验证明,用上图装置测定的AlN纯度偏高,原因是
 “氢”既是重要的化工原料,也是未来最理想的新能源.
“氢”既是重要的化工原料,也是未来最理想的新能源.(1)①实验测得,1g氢气燃烧生成液态水时放出142.9kJ热量,1mol H2O(g)转变为1mol H2O(l)时放出44.0kJ热量.则氢气燃烧生成H2O(g)的热化学方程式为
2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ?mol-1
2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ?mol-1
.②熔融碳酸盐燃料电池(MCFS)是使用熔融碳酸锂、碳酸钾作电解质的一种新型电池,该电池的工作温度为650℃.负极由镍铬铝合金烧结而成,正极材料为多孔镍,电池反应为:H2+CO+O2=CO2+H2O.下列说法不正确的是
AB
AB
A.负极反应Al-3e-=Al3+ B.燃料气体是氧气
C.正极反应为2CO2+O2+4e-=2CO32- D.该电池也可用烃类作燃料
(2)用CO2和氢气为原料,在催化剂作用下发生如下反应,
2CO2(g)+6H2(g)
| 催化剂 |
①该反应的平衡常数表达式K=
| c(CH3CH2OH).C3(H2O) |
| C2(CO2).C6(H2) |
| c(CH3CH2OH).C3(H2O) |
| C2(CO2).C6(H2) |
②在一定压强下,
| n(H2) |
| n(CO2) |
| 温度(K) | 500 | 600 | 700 | 800 |
| CO2转化率(%) | 60 | 43 | 28 | 15 |
减小
减小
(填“增大”、“减小”或“不变”);上述反应的焓变△H<
<
0(填“>”、“<”或“=”).③其它条件不变,适当提高c(CO2),则乙醇的产量
增大
增大
(填“增大”、“减小”或“不变”,下同.),此时K值不变
不变
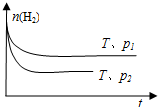
.④在一定温度下,H2的物质的量随时间的变化曲线如图,则p1
<
<
p2(填“>”、“<”或“=”). 、Al3+、S
、Al3+、S 、N
、N B.K+、Na+、Al
B.K+、Na+、Al 、N
、N
 、Mn
、Mn 、S
、S D.Na+、K+、N
D.Na+、K+、N 、HS
、HS
