题目内容
 “氢”既是重要的化工原料,也是未来最理想的新能源.
“氢”既是重要的化工原料,也是未来最理想的新能源.(1)①实验测得,1g氢气燃烧生成液态水时放出142.9kJ热量,1mol H2O(g)转变为1mol H2O(l)时放出44.0kJ热量.则氢气燃烧生成H2O(g)的热化学方程式为
2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ?mol-1
2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ?mol-1
.②熔融碳酸盐燃料电池(MCFS)是使用熔融碳酸锂、碳酸钾作电解质的一种新型电池,该电池的工作温度为650℃.负极由镍铬铝合金烧结而成,正极材料为多孔镍,电池反应为:H2+CO+O2=CO2+H2O.下列说法不正确的是
AB
AB
A.负极反应Al-3e-=Al3+ B.燃料气体是氧气
C.正极反应为2CO2+O2+4e-=2CO32- D.该电池也可用烃类作燃料
(2)用CO2和氢气为原料,在催化剂作用下发生如下反应,
2CO2(g)+6H2(g)
| 催化剂 |
①该反应的平衡常数表达式K=
| c(CH3CH2OH).C3(H2O) |
| C2(CO2).C6(H2) |
| c(CH3CH2OH).C3(H2O) |
| C2(CO2).C6(H2) |
②在一定压强下,
| n(H2) |
| n(CO2) |
| 温度(K) | 500 | 600 | 700 | 800 |
| CO2转化率(%) | 60 | 43 | 28 | 15 |
减小
减小
(填“增大”、“减小”或“不变”);上述反应的焓变△H<
<
0(填“>”、“<”或“=”).③其它条件不变,适当提高c(CO2),则乙醇的产量
增大
增大
(填“增大”、“减小”或“不变”,下同.),此时K值不变
不变
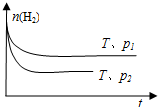
.④在一定温度下,H2的物质的量随时间的变化曲线如图,则p1
<
<
p2(填“>”、“<”或“=”).分析:(1)①实验测得,1g氢气的物质的量=
=0.5mol,0.5mol氢气燃烧生成液态水时放出142.9kJ热量,则2mol氢气完全燃烧生成液态水时放出483.6kJ热量,1mol H2O(g)转变为1mol H2O(l)时放出44.0kJ热量,根据盖斯定律书写热化学方程式;
②该燃料电池中,负极上燃料失电子发生氧化反应,正极上氧化剂得电子发生还原反应;
(2)①化学平衡常数等于生成物浓度幂之积与反应物浓度幂之积的比;
②根据温度和二氧化碳的转化率知,升高温度二氧化碳的转化率减小,则生成物浓度降低,平衡常数减小,升高温度平衡向吸热反应方向移动;
③增大反应物浓度,平衡向正反应方向移动,平衡常数只与温度有关;
④根据“先拐先平数值大”判断压强大小.
| 1g |
| 2g/mol |
②该燃料电池中,负极上燃料失电子发生氧化反应,正极上氧化剂得电子发生还原反应;
(2)①化学平衡常数等于生成物浓度幂之积与反应物浓度幂之积的比;
②根据温度和二氧化碳的转化率知,升高温度二氧化碳的转化率减小,则生成物浓度降低,平衡常数减小,升高温度平衡向吸热反应方向移动;
③增大反应物浓度,平衡向正反应方向移动,平衡常数只与温度有关;
④根据“先拐先平数值大”判断压强大小.
解答:解:(1)①实验测得,1g氢气的物质的量=
=0.5mol,0.5mol氢气燃烧生成液态水时放出142.9kJ热量,则2mol氢气完全燃烧生成液态水时放出483.6kJ热量,其热化学反应方程式为:2H2(g)+O2(g)=2H2O(g)△H=-571.6kJ?mol-1,1mol H2O(g)转变为1mol H2O(l)时放出44.0kJ热量,其热化学反应方程式为 H2O(g)=H2O(l)△H=-44.0kJ,根据盖斯定律知,氢气完全燃烧生成气态水的热化学反应方程式为2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ?mol-1,
故答案为:2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ?mol-1;
②根据电池反应式知,该燃料电池中,燃料是氢气和一氧化碳,氧化剂是氧气,
A.负极上燃料失电子发生氧化反应,电极反应式为CO-2e-+CO32-═2CO2、H2-2e-+CO32-═CO2+H2O,故错误;
B.该燃料电池中氧气是氧化剂,故错误;
C.正极上氧气得电子发生还原反应,所以正极反应为2CO2+O2+4e-=2CO32-,故正确;
D.烃中含有碳、氢元素,也可以作燃料,所以该电池也可用烃类作燃料,故正确;
故选AB;
(2)①化学平衡常数等于生成物浓度幂之积与反应物浓度幂之积的比,所以K=
;
故答案为:K=
;
②根据温度和二氧化碳的转化率知,升高温度,二氧化碳的转化率减小,则平衡向逆反应方向移动,乙醇的含量减小,所以平衡常数减小,升高温度平衡向吸热反应方向移动,向逆反应方向移动,说明正反应是放热反应,则焓变小于0,故答案为:减小;<;
③增大二氧化碳浓度,平衡向正反应方向移动,则有利于乙醇的产生,所以乙醇的产量增大,温度不变,则平衡常数不变,故答案为:增大; 不变;
④根据“先拐先平数值大”知,p1<p2,故答案为:<.
| 1g |
| 2g/mol |
故答案为:2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ?mol-1;
②根据电池反应式知,该燃料电池中,燃料是氢气和一氧化碳,氧化剂是氧气,
A.负极上燃料失电子发生氧化反应,电极反应式为CO-2e-+CO32-═2CO2、H2-2e-+CO32-═CO2+H2O,故错误;
B.该燃料电池中氧气是氧化剂,故错误;
C.正极上氧气得电子发生还原反应,所以正极反应为2CO2+O2+4e-=2CO32-,故正确;
D.烃中含有碳、氢元素,也可以作燃料,所以该电池也可用烃类作燃料,故正确;
故选AB;
(2)①化学平衡常数等于生成物浓度幂之积与反应物浓度幂之积的比,所以K=
| c(CH3CH2OH).C3(H2O) |
| C2(CO2).C6(H2) |
故答案为:K=
| c(CH3CH2OH).C3(H2O) |
| C2(CO2).C6(H2) |
②根据温度和二氧化碳的转化率知,升高温度,二氧化碳的转化率减小,则平衡向逆反应方向移动,乙醇的含量减小,所以平衡常数减小,升高温度平衡向吸热反应方向移动,向逆反应方向移动,说明正反应是放热反应,则焓变小于0,故答案为:减小;<;
③增大二氧化碳浓度,平衡向正反应方向移动,则有利于乙醇的产生,所以乙醇的产量增大,温度不变,则平衡常数不变,故答案为:增大; 不变;
④根据“先拐先平数值大”知,p1<p2,故答案为:<.
点评:本题考查了原电池原理、化学平衡的移动等知识点,难度不大,化学平衡移动的有关知识是高考热点,也是学习难点,难度中等.

练习册系列答案
相关题目
油脂既是重要的食物,又是重要的化工原料.油脂的以下性质和用途与其含有的不饱和碳碳双键有关的是( )
| A、适量摄入油脂,有助于人体吸收多种脂溶性维生素和胡萝卜素 | B、利用油脂在碱性条件下水解,可以生产甘油和肥皂 | C、植物油通过氢化,即与氢气发生加成反应,可以制造植物奶油(人造奶油) | D、天然油脂没有固定的熔沸点 |
 )有关的是( )
)有关的是( )