题目内容
(2012?河西区一模)下图中D、E、Z是单质,其余均是化合物.且知D、E为日常常用金属;D元素的原子最外层电子数与电子层数相等{无色气体N在Z中燃烧生成气体X;N、Z、Y是氯碱工业的产品;除反应①外,其他反应均在水溶液中进行.

请按要求回答下列问题:
(1)D在周期表中的位置:
 .
.
(2)G可做净水剂助剂,能加快悬浮物固体的沉降,请用离子方程式表示其原因:
(3)写出反应①的化学方程式:
(4)上图反应中不属于氧化还原反应的是(填编号)
(5)向含有0.2mol A和0.2mol X的混合溶液中,逐渐加入E粉末至过量(假设E与A完全反应后,再与X反应).请在坐标系中画出n(B)随n(E)变化的示意图:


请按要求回答下列问题:
(1)D在周期表中的位置:
第三周期,第ⅢA族
第三周期,第ⅢA族
;X的电子式为

(2)G可做净水剂助剂,能加快悬浮物固体的沉降,请用离子方程式表示其原因:
AlO2-+2H2O=Al(OH)3胶体+OH-
AlO2-+2H2O=Al(OH)3胶体+OH-
.(3)写出反应①的化学方程式:
2Al+3FeO
Al2O3+3Fe
| ||
2Al+3FeO
Al2O3+3Fe
.在B溶液中滴加黄色K3[Fe(CN)6]溶液,可观察到的现象是
| ||
生成有特征蓝色的沉淀
生成有特征蓝色的沉淀
.(4)上图反应中不属于氧化还原反应的是(填编号)
④⑦⑧⑨
④⑦⑧⑨
.(5)向含有0.2mol A和0.2mol X的混合溶液中,逐渐加入E粉末至过量(假设E与A完全反应后,再与X反应).请在坐标系中画出n(B)随n(E)变化的示意图:

分析:图中D、E、Z是单质,其余均是化合物.且知D、E为日常常用金属;D元素的原子最外层电子数与电子层数相等,C+D=E+F是置换反应,推断高温下为铝热反应,推断D为Al,E为Fe,F为Al2O3;N、Z、Y是氯碱工业的产品,依据Al、Al2O3和Y反应推断,Y为NaOH;除反应①外,无色气体N在Z中燃烧生成气体X,说明N为H2,得到Z为Cl2,X为HCl,反应均在水溶液中进行,所以推断得到G为NaAlO2,H为AlCl3;C为FeO,B为FeCl2,A为FeCl3;依据推断分析回答.
解答:解:图中D、E、Z是单质,其余均是化合物.且知D、E为日常常用金属;D元素的原子最外层电子数与电子层数相等,C+D=E+F是置换反应,推断高温下为铝热反应,推断D为Al,E为Fe,F为Al2O3;N、Z、Y是氯碱工业的产品,依据Al、Al2O3和Y反应推断,Y为NaOH;除反应①外,无色气体N在Z中燃烧生成气体X,说明N为H2,得到Z为Cl2,X为HCl,反应均在水溶液中进行,所以推断得到G为NaAlO2,H为AlCl3;C为FeO,B为FeCl2,A为FeCl3;
(1)D元素为Al元素,在周期表中的位置第三周期,第ⅢA族;X为HCl电子式为: ,
,
故答案为:第三周期,第ⅢA族; ;
;
(2)G为NaAlO2可做净水剂助剂,能加快悬浮物固体的沉降,是因为偏铝酸根离子水解生成氢氧化铝胶体的作用,反应的离子方程式为AlO2-+2H2O=Al(OH)3胶体+OH-,
故答案为:AlO2-+2H2O=Al(OH)3胶体+OH-;
(3)反应①是铝热反应,铝和氧化亚铁在高温下反应生成铁和氧化铝,反应的化学方程式:2Al+3FeO
Al2O3+3Fe;B为FeCl2,在B溶液中滴加黄色K3[Fe(CN)6]溶液,是亚铁离子的检验方法,可观察到的现象是生成特征蓝色的沉淀,
故答案为:2Al+3FeO
Al2O3+3Fe;生成有特征蓝色的沉淀;
(4)上图反应中不属于氧化还原反应的是反应过程中无元素化合价变化的,
①2Al+3FeO
Al2O3+3Fe,是氧化还原反应;
②2FeCl2+Cl2=2FeCl3,是氧化还原反应;
③2FeCl3+Fe=3FeCl2,是氧化还原反应;
④FeO+2HCl=FeCl2+H2O,不是氧化还原反应;
⑤Fe+2HCl=FeCl2+H2↑是氧化还原反应;
⑥2Al+2NaOH+2H2O=2NaAlO2+3H2↑,是氧化还原反应;
⑦Al2O3+2NaOH+3H2O=2NaAl(OH)4,不是氧化还原反应;
⑧NaAlO2+4HCl=NaCl+AlCl3+2H2O,不是氧化还原反应;
⑨AlCl3+4NaOH=NaAlO2+3NaCl,不是氧化还原反应
故答案为:④⑦⑧⑨;
(5)向含有0.2mol A(FeCl3)和0.2mol X(HCl)的混合溶液中,逐渐加入E(Fe)粉末至过量(假设E与A完全反应后,再与X反应);
反应的化学方程式为:2FeCl3+Fe=3FeCl2,Fe+2HCl=FeCl2+H2↑依据离子氧化性,三价铁离子先和铁反应,0.2molFe3+完全反应需要铁0.1mol,生成0.3molFe2+,铁离子反应完后,再和氯化氢反应,0.2molHCl消耗0.1molFe,生成0.1molFeCl2,在坐标系中画出n(FeCl2)随n(Fe)变化的示意图为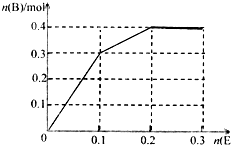 ,故答案为:
,故答案为: .
.
(1)D元素为Al元素,在周期表中的位置第三周期,第ⅢA族;X为HCl电子式为:
 ,
,故答案为:第三周期,第ⅢA族;
 ;
;(2)G为NaAlO2可做净水剂助剂,能加快悬浮物固体的沉降,是因为偏铝酸根离子水解生成氢氧化铝胶体的作用,反应的离子方程式为AlO2-+2H2O=Al(OH)3胶体+OH-,
故答案为:AlO2-+2H2O=Al(OH)3胶体+OH-;
(3)反应①是铝热反应,铝和氧化亚铁在高温下反应生成铁和氧化铝,反应的化学方程式:2Al+3FeO
| ||
故答案为:2Al+3FeO
| ||
(4)上图反应中不属于氧化还原反应的是反应过程中无元素化合价变化的,
①2Al+3FeO
| ||
②2FeCl2+Cl2=2FeCl3,是氧化还原反应;
③2FeCl3+Fe=3FeCl2,是氧化还原反应;
④FeO+2HCl=FeCl2+H2O,不是氧化还原反应;
⑤Fe+2HCl=FeCl2+H2↑是氧化还原反应;
⑥2Al+2NaOH+2H2O=2NaAlO2+3H2↑,是氧化还原反应;
⑦Al2O3+2NaOH+3H2O=2NaAl(OH)4,不是氧化还原反应;
⑧NaAlO2+4HCl=NaCl+AlCl3+2H2O,不是氧化还原反应;
⑨AlCl3+4NaOH=NaAlO2+3NaCl,不是氧化还原反应
故答案为:④⑦⑧⑨;
(5)向含有0.2mol A(FeCl3)和0.2mol X(HCl)的混合溶液中,逐渐加入E(Fe)粉末至过量(假设E与A完全反应后,再与X反应);
反应的化学方程式为:2FeCl3+Fe=3FeCl2,Fe+2HCl=FeCl2+H2↑依据离子氧化性,三价铁离子先和铁反应,0.2molFe3+完全反应需要铁0.1mol,生成0.3molFe2+,铁离子反应完后,再和氯化氢反应,0.2molHCl消耗0.1molFe,生成0.1molFeCl2,在坐标系中画出n(FeCl2)随n(Fe)变化的示意图为
 ,故答案为:
,故答案为: .
.点评:本题考查了无机推断和物质性质的综合应用,转化关系的理解应用,主要是铝及其化合物,铁及其化合物性质的分析判断,反应过程图象分析,题目难度较大.

练习册系列答案
相关题目

