网址:http://m.1010jiajiao.com/timu3_id_49343[举报]
1.《有机化学基础》
已知:两个羟基同时连在同一碳原子上的结构是不稳定的,它将发生脱水反应:

现有分子式为C9H8O2Br2的物质M,有机物C的相对分子质量为60,在一定条件下可发生下述一系列反应:

请回答下列问题:
(1)G→H的反应类型是_______________。
(2)M的结构简式为_______________;C的结构简式为_______________。
(3)写出下列反应的化学方程式:
①A→B的化学方程式:________________________________________________________;
②H→I的化学方程式:_________________________________________________________。
2.《物质结构与性质》Ⅰ.图表法、图像法是常用的科学研究方法。


图A 图B
(1)短周期某主族元素M的电离能情况如图A所示。则M元素位于周期表的第_____族。
(2)图B是研究部分元素的氢化物的沸点变化规律的图像,折线c可以表达出第_____族元素氢化物的沸点的变化规律。不同同学对某主族元素氢化物的沸点的变化趋势画出了两条折线——折线a和折线b,你认为正确的是_____(填“a”或“b”)。
Ⅱ.人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属被科学家预测为是钛(22Ti),它被誉为“未来世纪的金属”。试回答下列问题:
(3)Ti元素的基态原子的价电子层排布式为____________。
(4)在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定;偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用。偏钛酸钡晶体中晶胞的结构示意图如下图,它的化学式是__________;晶体内与每个“Ti”紧邻的氧原子数为_________个。

(5)已知Ti3+可形成配位数为6的配合物。现有含钛的两种颜色的晶体,一种为紫色,另一种为绿色,但相关实验证明,两种晶体的组成皆为TiCl3·6H2O。为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种配合物晶体的样品配成待测溶液;b.分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量,发现原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的![]() 。则绿色晶体配合物的化学式为_______________。
。则绿色晶体配合物的化学式为_______________。
图表法、图象法是常用的科学研究方法.下表列出前20号元素中的某些元素性质的一些数据:
| 元素 性质 |
A | B | C | D | E | F | G | H | I | J |
| 原子半径(10-10m) | 1.02 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
| 最高价态 | +6 | +1 | - | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
| 最低价态 | -2 | - | -2 | - | -4 | -3 | -1 | - | -3 | -4 |
(1)以上10种元素中第一电离能最小的是:
(2)由上述C、E、G三种元素中的某两种元素形成的化合物中,每个原子的最外层都满足8电子稳定结构的可能是
(3)元素E与C及氢元素可形成一种相对分子质量为60的一元羧酸分子.其分子中共形成
(4)短周期某主族元素K的电离能情况如图(A)所示.则K元素位于周期表的第

图B是研究部分元素的氢化物的沸点变化规律的图象,折线c可以表达出第
 [化学--选修物质结构与性质]目前,我省多地正在积极推广使用太阳能.常见的太阳能电池有单晶硅太阳能电池、多 晶硅太阳能电池、GaAs太阳能电池及铜铟镓硒薄膜太阳能电池等.
[化学--选修物质结构与性质]目前,我省多地正在积极推广使用太阳能.常见的太阳能电池有单晶硅太阳能电池、多 晶硅太阳能电池、GaAs太阳能电池及铜铟镓硒薄膜太阳能电池等.(1)Cu+在基态时的价电子排布式为
(2)砷、硒是第四周期的相邻元素,已知砷的第一电离能(947kJ?mol-1)大于硒(941kJ?mol-1).请从原子结构的角度加以解释
(3)As2O3俗名砒霜,是一种剧毒物质.法医检验砒霜中毒的方法是:向试样中加入锌粉和盐酸,如果有砒霜,将生成无色气体AsH3,将气体导入热玻璃管会分解成亮黑色的“砷 镜”,这就是著名的“马氏验砷法”.请用化学方程式表示检验原理:
(4)硼酸(H3BO3)在水溶液中易结合一个OH-生成[B(OH)4]-,而体现弱酸性.
①[B(OH)4]-中B原子的杂化类型为
②[B(OH)4]-的结构式为
(5)金刚石的晶胞如图,若以硅原子代替金刚石晶体中的碳原子,便得到晶体硅;若将金刚石晶体中一半的碳原子换成硅原子,且碳、硅原 子交替,即得到碳化硅晶体(金刚砂).
①金刚石、晶体硅、碳化硅的熔点由高到低的排列顺序是
②立方氮化硼晶体的结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm.立方氮化硼晶胞中含有
一水硫酸四氨合铜(Ⅱ)(化学式为[Cu(NH3)4SO4?H2O]是一种重要的染料及农药中间体.某学习小组以孔雀石(主要成分为Cu2(OH)2CO3,含少量Fe2O3和SO2杂质)为原料制备该物质的流程如下图:

请回答:
(1)沉淀A的晶体中最小环上的原子个数为
2)溶液D的溶质阴离子的空间构型为
3)MgO的熔点高于CuO的原因为
4)画出一水硫酸四氨合铜(Ⅱ)中配离子([Cu(NH3)4]2+)的配位键
(5)湿法炼铜就是利用溶液D制得铜单质,铜单质晶体中原子的堆积方式如图甲所示,其晶胞如图乙所示,原子之间相互位置关系的平面图如图丙所示.
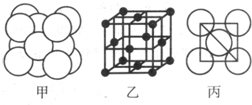
①铜单质晶体中原子的堆积方式为
若Cu原子半径为acm,则Cu单质晶体的密度为
 本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选定其中一题,并在相应和答题区域内作答.若两题都做,则按A题评分.
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容.请选定其中一题,并在相应和答题区域内作答.若两题都做,则按A题评分.
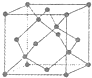
A.海底热液研究(图1)处于当今科研的前沿.海底热液活动区域“黑烟囱”的周围常存在FeS、黄铜矿及锌矿等矿物.
(1)Ni2+的核外电子排布式是
(2)分析下表,铜的第一电离能(I1)小于锌的第一电离能,而铜的第二电离能(I2)却大于锌的第二电离能,基主要原因是
| 电离能/kJ?mol-1 | I1 | I2 |
| 铜 | 746 | 1958 |
| 锌 | 906 | 1733 |
A.电负性:N>O>S>C B.CO2与COS(硫化羰)互为等电子体
C.NH3分子中氮原子采用sp3杂化 D.CO、H2S、HCN都是极性分子
(4)“酸性热液”中大量存在一价阳离子,结构如图2,它的化学式为
(5)FeS与NaCl均为离子晶体,晶胞相似,前者熔点为985℃,后者801℃,其原因是
B.制备KNO3晶体的实质是利用结晶和重结晶法对KNO3和NaCl的混合物进行分离.下面是某化学兴趣小组的活动记录:
| NaNO3 | KNO3 | NaCl | KCl | |
| 10℃ | 80.5 | 20.9 | 35.7 | 31.0 |
| 100℃ | 175 | 246 | 39.1 | 56.6 |
实验方案:
Ⅰ.溶解:称取29.8g KCl和34.0g NaNO3放入250mL烧杯中,再加入70.0g蒸馏水,加热并搅拌,使固体全部溶解.
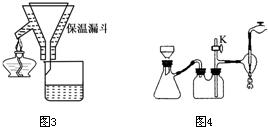
Ⅱ.蒸发结晶:继续加热和搅拌,将溶液蒸发浓缩.在100℃时蒸发掉50.0g 水,维持该温度,在保温漏斗(如图3所示)中趁热过滤析出的晶体.得晶体m1g.
Ⅲ.冷却结晶:待溶液冷却至室温(实验时室温为10℃)后,进行减压过滤.得KNO3粗产品m2g.
Ⅳ.重结晶:将粗产品全部溶于水,制成100℃的饱和溶液,冷却至室温后抽滤.得KNO3纯品.
假定:①盐类共存时不影响各自的溶解度;②各种过滤操作过程中,溶剂的损耗忽略不计.试回答有关问题:
(1)操作Ⅱ中趁热过滤的目的是.
(2)若操作Ⅱ中承接滤液的烧杯中不加入蒸馏水,则理论上在操作Ⅲ中可得粗产品的质量m2=
(3)操作Ⅲ中采用减压过滤,其优点是