题目内容
[化学──选修物质结构与性质]
图表法、图象法是常用的科学研究方法.下表列出前20号元素中的某些元素性质的一些数据:
试回答下列问题:
(1)以上10种元素中第一电离能最小的是: (填编号).比元素B原子序数大10的元素在元素周期表中的位置: 周期, 族,其基态原子的核外电子排布是 .
(2)由上述C、E、G三种元素中的某两种元素形成的化合物中,每个原子的最外层都满足8电子稳定结构的可能是 (写分子式,写出两种即可),元素G、I分别和J形成的两种化合物的晶体类型分别是 .
(3)元素E与C及氢元素可形成一种相对分子质量为60的一元羧酸分子.其分子中共形成 个σ键, 个π键.
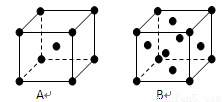
(4)短周期某主族元素K的电离能情况如图(A)所示.则K元素位于周期表的第 族.

图B是研究部分元素的氢化物的沸点变化规律的图象,折线c可以表达出第 族元素氢化物的沸点的变化规律.不同同学对某主族元素的氢化物的沸点的变化趋势画出了两条折线-折线a和折线b,你认为正确的是 ,理由是 .
图表法、图象法是常用的科学研究方法.下表列出前20号元素中的某些元素性质的一些数据:
| 元素 性质 |
A | B | C | D | E | F | G | H | I | J |
| 原子半径(10-10m) | 1.02 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
| 最高价态 | +6 | +1 | - | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
| 最低价态 | -2 | - | -2 | - | -4 | -3 | -1 | - | -3 | -4 |
(1)以上10种元素中第一电离能最小的是:
(2)由上述C、E、G三种元素中的某两种元素形成的化合物中,每个原子的最外层都满足8电子稳定结构的可能是
(3)元素E与C及氢元素可形成一种相对分子质量为60的一元羧酸分子.其分子中共形成
(4)短周期某主族元素K的电离能情况如图(A)所示.则K元素位于周期表的第

图B是研究部分元素的氢化物的沸点变化规律的图象,折线c可以表达出第
分析:前20号元素中,AC都有最低价-2,处于VIA族,A有+6价,C只有-2价,则A为S、C为O元素;E、J都有+4、-4价,处于IVA族,E的原子半径较小,则E是C元素、J是Si;F、I都有+5、-3价,处于VA族,F的原子半径大于I,则F是P元素、I是N元素;G有+7、-1价,为ⅦA族元素,G是Cl元素;D只有+3价,为ⅢA族元素,原子半径大于Si原子半径,所以D是Al元素;B、H最高正价为+1,没有负价,处于IA族,B的原子半径比Al原子半径大很多,不能处于同周期,则B为K,B、H原子半径相差不是太大,应相邻,则H为Na,
(1)同周期自左而右第一电离能呈增大趋势,同主族自上而下第一电离能减小;比元素B原子序数大10的元素为Cu,处于第三周期ⅠB族,结合能量最低原理书写核外电子排布式;
(2)O、P、Cl三种元素中的某两种元素形成的化合物中,每一个原子都满足8电子稳定结构的物质可能是:CO2或PCl3或CCl4;元素Cl、N分别和Si形成的两种化合物为SiCl4、Si3N4,前者属于分子晶体,后者属于原子晶体;
(3)碳元素、氧元素及氢元素可形成一种相对分子质量为60的一元羧酸分子,该羧酸为CH3COOH;
(4)因第三和第四电离能之间发生突变,所以该元素最外层有3个电子,据此确定;
线c逐渐上升,表明没有氢键的影响,是第ⅣA族元素氢化物的沸点变化规律;
A点所示的氢化物是水,氧族元素中其他氢化物的沸点不会高于水.
(1)同周期自左而右第一电离能呈增大趋势,同主族自上而下第一电离能减小;比元素B原子序数大10的元素为Cu,处于第三周期ⅠB族,结合能量最低原理书写核外电子排布式;
(2)O、P、Cl三种元素中的某两种元素形成的化合物中,每一个原子都满足8电子稳定结构的物质可能是:CO2或PCl3或CCl4;元素Cl、N分别和Si形成的两种化合物为SiCl4、Si3N4,前者属于分子晶体,后者属于原子晶体;
(3)碳元素、氧元素及氢元素可形成一种相对分子质量为60的一元羧酸分子,该羧酸为CH3COOH;
(4)因第三和第四电离能之间发生突变,所以该元素最外层有3个电子,据此确定;
线c逐渐上升,表明没有氢键的影响,是第ⅣA族元素氢化物的沸点变化规律;
A点所示的氢化物是水,氧族元素中其他氢化物的沸点不会高于水.
解答:解:(1)同周期自左而右第一电离能呈增大趋势,同主族自上而下第一电离能减小,故上述元素中K元素的第一电离能最小;比元素B原子序数大10的元素为Cu,处于第三周期ⅠB族,基态原子核外电子排布为:1s22s22P63s23P63d104s1,
故答案为:B;三、ⅠB;1s22s22P63s23P63d104s1;
(2)O、P、Cl三种元素中的某两种元素形成的化合物中,每一个原子都满足8电子稳定结构的物质可能是:CO2或PCl3或CCl4;
元素Cl、N分别和Si形成的两种化合物为SiCl4、Si3N4,前者属于分子晶体,后者属于原子晶体,
故答案为:CO2、PCl3或CCl4;分子晶体、原子晶体;
(3)碳元素、氧元素及氢元素可形成一种相对分子质量为60的一元羧酸分子,该羧酸为CH3COOH,其分子中共形成7个σ键,1个π键,
故答案为:7;1;
(4)因第三和第四电离能之间发生突变,所以该元素最外层有3个电子,处于ⅢA族;
线c逐渐上升,表明没有氢键的影响,是第ⅣA族元素氢化物的沸点变化规律.A点所示的氢化物是水,其沸点高是由于水分子间存在氢键,其强度远大于分子间作用力,所以氧族元素中其他氢化物的沸点不会高于水,故b正确,
故答案为:ⅢA;ⅣA;b;A点所示的氢化物是水,由于水分子间存在氢键,其强度远大于分子间作用力,所以氧族元素中其他氢化物的沸点不会高于水.
故答案为:B;三、ⅠB;1s22s22P63s23P63d104s1;
(2)O、P、Cl三种元素中的某两种元素形成的化合物中,每一个原子都满足8电子稳定结构的物质可能是:CO2或PCl3或CCl4;
元素Cl、N分别和Si形成的两种化合物为SiCl4、Si3N4,前者属于分子晶体,后者属于原子晶体,
故答案为:CO2、PCl3或CCl4;分子晶体、原子晶体;
(3)碳元素、氧元素及氢元素可形成一种相对分子质量为60的一元羧酸分子,该羧酸为CH3COOH,其分子中共形成7个σ键,1个π键,
故答案为:7;1;
(4)因第三和第四电离能之间发生突变,所以该元素最外层有3个电子,处于ⅢA族;
线c逐渐上升,表明没有氢键的影响,是第ⅣA族元素氢化物的沸点变化规律.A点所示的氢化物是水,其沸点高是由于水分子间存在氢键,其强度远大于分子间作用力,所以氧族元素中其他氢化物的沸点不会高于水,故b正确,
故答案为:ⅢA;ⅣA;b;A点所示的氢化物是水,由于水分子间存在氢键,其强度远大于分子间作用力,所以氧族元素中其他氢化物的沸点不会高于水.
点评:本题考查元素周期表与元素周期律的综合应用,为高考常见题型,侧重对学生分析能力的考查,注意把握原子半径的递变规律、化合价与位置关系,确定元素是解答关键,难度中等.

练习册系列答案
相关题目