题目内容
 [化学--选修物质结构与性质]目前,我省多地正在积极推广使用太阳能.常见的太阳能电池有单晶硅太阳能电池、多 晶硅太阳能电池、GaAs太阳能电池及铜铟镓硒薄膜太阳能电池等.
[化学--选修物质结构与性质]目前,我省多地正在积极推广使用太阳能.常见的太阳能电池有单晶硅太阳能电池、多 晶硅太阳能电池、GaAs太阳能电池及铜铟镓硒薄膜太阳能电池等.(1)Cu+在基态时的价电子排布式为
(2)砷、硒是第四周期的相邻元素,已知砷的第一电离能(947kJ?mol-1)大于硒(941kJ?mol-1).请从原子结构的角度加以解释
(3)As2O3俗名砒霜,是一种剧毒物质.法医检验砒霜中毒的方法是:向试样中加入锌粉和盐酸,如果有砒霜,将生成无色气体AsH3,将气体导入热玻璃管会分解成亮黑色的“砷 镜”,这就是著名的“马氏验砷法”.请用化学方程式表示检验原理:
(4)硼酸(H3BO3)在水溶液中易结合一个OH-生成[B(OH)4]-,而体现弱酸性.
①[B(OH)4]-中B原子的杂化类型为
②[B(OH)4]-的结构式为
(5)金刚石的晶胞如图,若以硅原子代替金刚石晶体中的碳原子,便得到晶体硅;若将金刚石晶体中一半的碳原子换成硅原子,且碳、硅原 子交替,即得到碳化硅晶体(金刚砂).
①金刚石、晶体硅、碳化硅的熔点由高到低的排列顺序是
②立方氮化硼晶体的结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm.立方氮化硼晶胞中含有
分析:(1)铜是29号元素,其原子核外有29个电子,根据构造原理书写Cu+在基态时的价电子排布式;
(2)根据砷、硒价电子排布谁更稳定分析;
(3)根据题目信息砒霜、锌粉和盐酸为反应物,生成物之一为AsH3,根据质量守恒定律可写出反应的化学方程式;
(4)①根据价层电子对互斥理论确定其杂化方式,价层电子对数=δ键数+孤对电子对数;
②根据杂化轨道类型及杂化轨道成键情况写[B(OH)4]-的结构式,[B(OH)4]-中含有配位键;
(5)①中形成的晶体都是原子晶体.由于键长C-C<C-Si<Si-Si,则熔点为金刚石>碳化硅>晶体硅;
②因为金刚石属于面心立方晶胞,即C原子处在立方体的8个顶点,6个面心,体内有4个,故根据均摊法及BN的化学式可推知,一个晶胞中各含有4个B原子、4个N原子,又因为一个BN的质量是M/NA,而一个晶胞的体积是(361.5×10-10)3cm3,故根据密度=质量÷体积可得解.
(2)根据砷、硒价电子排布谁更稳定分析;
(3)根据题目信息砒霜、锌粉和盐酸为反应物,生成物之一为AsH3,根据质量守恒定律可写出反应的化学方程式;
(4)①根据价层电子对互斥理论确定其杂化方式,价层电子对数=δ键数+孤对电子对数;
②根据杂化轨道类型及杂化轨道成键情况写[B(OH)4]-的结构式,[B(OH)4]-中含有配位键;
(5)①中形成的晶体都是原子晶体.由于键长C-C<C-Si<Si-Si,则熔点为金刚石>碳化硅>晶体硅;
②因为金刚石属于面心立方晶胞,即C原子处在立方体的8个顶点,6个面心,体内有4个,故根据均摊法及BN的化学式可推知,一个晶胞中各含有4个B原子、4个N原子,又因为一个BN的质量是M/NA,而一个晶胞的体积是(361.5×10-10)3cm3,故根据密度=质量÷体积可得解.
解答:解:(1)铜是29号元素,其原子核外有29个电子,根据构造原理知,其基态原子核外电子排布式为:1s22s22p63s23p63d104s1或[Ar]3d104s1,则Cu+在基态时的价电子排布式为3d10,故答案为:3d10;
(2)砷的价电子排布式是4s24p3,4p轨道上的电子处于半充满状态,比较稳定,气态原子失去一个电子需要的能量比较大,而硒的价电子排布式是4s2 4p4,4p轨道上失去一个电子才处于半充满状态,故第一电离能较小,
故答案为:砷的价电子排布式是4s24p3,4p轨道上的电子处于半充满状态,比较稳定,气态原子失去一个电子需要的能量比较大;
(3)根据题目信息砒霜、锌粉和盐酸为反应物,生成物之一为AsH3,根据质量守恒定律可写出反应的化学方程式,故答案为:As2O3+12HCl+6Zn=6ZnCl2+2AsH3↑+3H2O;2AsH3
2As+3H2;
(4)①[B(OH)4]-中B的价层电子对=4+
(3+1-4×1)=4,所以采取sp3杂化,故答案为:sp3;
②B原子是缺电子原子,所以该离子中还含有配位键,其结构为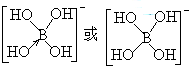 ,
,
故答案为: ;
;
(5)①中形成的晶体都是原子晶体.由于键长C-C<C-Si<Si-Si,则熔点为金刚石>碳化硅>晶体硅,
故答案为:C>SiC>Si;
②因为金刚石属于面心立方晶胞,即C原子处在立方体的8个顶点,6个面心,体内有4个,故根据均摊法及BN的化学式可推知,一个晶胞中各含有4个B原子、4个N原子,又因为一个BN的质量是M/NA,而一个晶胞的体积是(361.5×10-10)3cm3,故密度=质量÷体积=
g?cm-3,
故答案为:4;4;
.
(2)砷的价电子排布式是4s24p3,4p轨道上的电子处于半充满状态,比较稳定,气态原子失去一个电子需要的能量比较大,而硒的价电子排布式是4s2 4p4,4p轨道上失去一个电子才处于半充满状态,故第一电离能较小,
故答案为:砷的价电子排布式是4s24p3,4p轨道上的电子处于半充满状态,比较稳定,气态原子失去一个电子需要的能量比较大;
(3)根据题目信息砒霜、锌粉和盐酸为反应物,生成物之一为AsH3,根据质量守恒定律可写出反应的化学方程式,故答案为:As2O3+12HCl+6Zn=6ZnCl2+2AsH3↑+3H2O;2AsH3
| ||
(4)①[B(OH)4]-中B的价层电子对=4+
| 1 |
| 2 |
②B原子是缺电子原子,所以该离子中还含有配位键,其结构为
 ,
,故答案为:
 ;
;(5)①中形成的晶体都是原子晶体.由于键长C-C<C-Si<Si-Si,则熔点为金刚石>碳化硅>晶体硅,
故答案为:C>SiC>Si;
②因为金刚石属于面心立方晶胞,即C原子处在立方体的8个顶点,6个面心,体内有4个,故根据均摊法及BN的化学式可推知,一个晶胞中各含有4个B原子、4个N原子,又因为一个BN的质量是M/NA,而一个晶胞的体积是(361.5×10-10)3cm3,故密度=质量÷体积=
| 25×4 |
| (361.5×10-10)3×NA |
故答案为:4;4;
| 25×4 |
| (361.5×10-10)3×NA |
点评:本题考查原子核外电子排布;元素电离能;晶体熔点的比较;晶胞的计算;原子轨道杂化方式及杂化类型判断.该题是中等难度的试题,也是高考中的常见考点,试题针对性强,注重基础,有利于培养学生的逻辑推理能力,提高学生的学习效率.明确不同类型题目的解题方法是解答本题的关键.

练习册系列答案
相关题目