摘要:32.[化学--选修物质结构与性质] 生物质能是一种洁净.可再生的能源.生物质气(主要成分为CO.CO2.H2等)与H2混合.催化合成甲醇是生物质能利用的方法之一. (1)上述反应的催化剂含有Cu.Zn.Al等元素.写出基态Zn原子的核外电子排布式 . (2)根据等电子原理.写出CO分子结构式 . (3)甲醇催化氧化可得到甲醛.甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀. ①甲醇的沸点比甲醛高.其主要原因是 ,甲醛分子中碳原子轨道的杂化类型为 . ②甲醛分子的空间构型是 ,1 mol甲醛分子中σ键的数目为 . ③在1个Cu2O晶胞中.所包含的Cu原子数目为 .
网址:http://m.1010jiajiao.com/timu3_id_419171[举报]
 [化学-选修物质结构与性质]
[化学-选修物质结构与性质]Q、R、X、Y、Z为周期表前四周期元素,原子序数依次递增.已知:
①Q为周期表中原子半径最小的元素;
②R的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;
③Y的基态原子的核外成对电子数是未成对电子数的3倍;
④Z有“生物金属”之称,Z4+离子和氩原子的核外电子排布相同.
请回答下列问题:(答题时,Q、R、X、Y、Z用所对应的元素符号表示)
(1)RQ4Y分子的某中心原子采用的杂化轨道类型是
sp3
sp3
杂化.(2)R、X、Y三种元素的第一电离能由小到大的顺序为
C<O<N
C<O<N
.(3)已知:原子数目和电子总数(或价电子总数)相同的微粒互为等电子体,等电子体具有相似的结构特征.与RY分子互为等电子体的分子和离子分别为
N2
N2
和CN-
CN-
(填化学式).(4)Z元素位于周期表的
d
d
分区.Z原子基态时的外围电子排布式为3d24s2
3d24s2
,Z的一种含氧酸钡盐的晶胞结构如图所示,晶体内与每个“Z”原子等距离且最近的氧原子数为6
6
.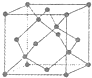 [化学--选修物质结构与性质]目前,我省多地正在积极推广使用太阳能.常见的太阳能电池有单晶硅太阳能电池、多 晶硅太阳能电池、GaAs太阳能电池及铜铟镓硒薄膜太阳能电池等.
[化学--选修物质结构与性质]目前,我省多地正在积极推广使用太阳能.常见的太阳能电池有单晶硅太阳能电池、多 晶硅太阳能电池、GaAs太阳能电池及铜铟镓硒薄膜太阳能电池等.(1)Cu+在基态时的价电子排布式为
(2)砷、硒是第四周期的相邻元素,已知砷的第一电离能(947kJ?mol-1)大于硒(941kJ?mol-1).请从原子结构的角度加以解释
(3)As2O3俗名砒霜,是一种剧毒物质.法医检验砒霜中毒的方法是:向试样中加入锌粉和盐酸,如果有砒霜,将生成无色气体AsH3,将气体导入热玻璃管会分解成亮黑色的“砷 镜”,这就是著名的“马氏验砷法”.请用化学方程式表示检验原理:
(4)硼酸(H3BO3)在水溶液中易结合一个OH-生成[B(OH)4]-,而体现弱酸性.
①[B(OH)4]-中B原子的杂化类型为
②[B(OH)4]-的结构式为
(5)金刚石的晶胞如图,若以硅原子代替金刚石晶体中的碳原子,便得到晶体硅;若将金刚石晶体中一半的碳原子换成硅原子,且碳、硅原 子交替,即得到碳化硅晶体(金刚砂).
①金刚石、晶体硅、碳化硅的熔点由高到低的排列顺序是
②立方氮化硼晶体的结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm.立方氮化硼晶胞中含有
[化学选修-物质结构与性质]
元素周期律是20世纪科学技术发展的重要理论依据之一.已知A、B、C、D、E五种元素都是元素周期表中前20号元素.A、B、C、D四种元素在元素周期表(长式)中的相对位置如下图所示,B、C、D的最高价氧化物的水化物两两混合,均能发生反应生成盐和水.E元素的原子序数均大于A、B、C、D元素,且不与A、B、C、D元素位于同主族.
根据以上信息,回答下列问题:
(1)上述A、B、C、D四种元素中第一电离能最小的是 ,电负性最大的是 .(填相关元素的元素符号)
(2)A和D的氢化物中,沸点较高的是 (填相关物质的分子式);其原因是 .
(3)A和E可组成离子化合物,其晶胞(在晶体中具有代表性的最小重复单元)结构如下图所示:
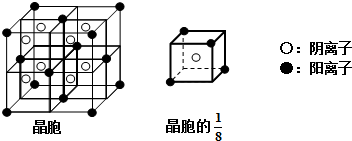
阳离子位于该正方体的顶点或面心;阴离子均位于小正方体中心.该化合物化学式为 .
查看习题详情和答案>>
元素周期律是20世纪科学技术发展的重要理论依据之一.已知A、B、C、D、E五种元素都是元素周期表中前20号元素.A、B、C、D四种元素在元素周期表(长式)中的相对位置如下图所示,B、C、D的最高价氧化物的水化物两两混合,均能发生反应生成盐和水.E元素的原子序数均大于A、B、C、D元素,且不与A、B、C、D元素位于同主族.
| … | A | |||||
| B | C | D |
(1)上述A、B、C、D四种元素中第一电离能最小的是
(2)A和D的氢化物中,沸点较高的是
(3)A和E可组成离子化合物,其晶胞(在晶体中具有代表性的最小重复单元)结构如下图所示:

阳离子位于该正方体的顶点或面心;阴离子均位于小正方体中心.该化合物化学式为
 [化学-选修物质结构与性质]现有A、B、C、D、E、F六种物质或粒子,其中A、B、C、D都具有如图所示的结构或结构单元(图形以外可能有的部分未画出,虚线不表示化学键或分子间作用力,X、Y可以相同也可以不同).A、B的晶体类型相同,单质A的同素异形体能与B物质发生置换反应.C、D、E、F含有相同的电子数,且D是阳离子,D与F的组成元素相同.C、E、F的晶体类型相同,由E构成的物质常温下呈液态.
[化学-选修物质结构与性质]现有A、B、C、D、E、F六种物质或粒子,其中A、B、C、D都具有如图所示的结构或结构单元(图形以外可能有的部分未画出,虚线不表示化学键或分子间作用力,X、Y可以相同也可以不同).A、B的晶体类型相同,单质A的同素异形体能与B物质发生置换反应.C、D、E、F含有相同的电子数,且D是阳离子,D与F的组成元素相同.C、E、F的晶体类型相同,由E构成的物质常温下呈液态.(1)写出单质A的同素异形体与B物质发生置换反应的化学方程式①
(2)上述六种物质或粒子的组成元素中有三种处于同一周期,请写出这三种元素第一电离能由大到小的顺序
(3)F分子的空间构型是①
(4)C分子的中心原子杂化类型是
[化学--选修物质结构与性质]
已知A、B、C、D、E、F、G位于元素周期表的前四周期,且元素原子序数依次增加,A焰色反应呈黄色;工业常用电解B的熔融的氯化物来制备B,C是一种能被HF和NaOH溶液溶解的单质,D的电负性比磷大,第一电离能却比磷小,E单质是制备漂白液的原料,F能形成红色(或砖红色)和黑色的两种氧化物,G是一种主族金属.
(1)前四周期所有元素中,基态原子中未成对电子与其所在周期数相同的元素有 种.
(2)元素A、B、C分别与氟气化合形成物质X、Y、Z熔点见下表:
解释表中氟化物熔点差异的原因: .
(3)已知常温条件下,极性分子DOE2是一种液态化合物,中心原子D的杂化方式是 .向盛有10mL水的锥形瓶中滴加少量的DOE2溶液,生成两种有刺激性气味的气体.请书写此反应的化学方程式 .
(4)G与氮原子可1:1化合,形成人工合成的新型半导体材料,其晶体结构与单晶硅相似.G原子的价电子排布式为 .在该合成材料中,与同一个G原子相连的N原子构成的空间构型为正四面体.在四种基本晶体类型中,此晶体属于 晶体.
(5)F晶体的堆积方式是 (填堆积名称),其配位数为 . 向F的硫酸盐溶液中滴加氨水直至过量,写出此过程所涉及的两个离子方程式 根据价层电子对互斥理论,预测SO42-的空间构型为 .
查看习题详情和答案>>
已知A、B、C、D、E、F、G位于元素周期表的前四周期,且元素原子序数依次增加,A焰色反应呈黄色;工业常用电解B的熔融的氯化物来制备B,C是一种能被HF和NaOH溶液溶解的单质,D的电负性比磷大,第一电离能却比磷小,E单质是制备漂白液的原料,F能形成红色(或砖红色)和黑色的两种氧化物,G是一种主族金属.
(1)前四周期所有元素中,基态原子中未成对电子与其所在周期数相同的元素有
(2)元素A、B、C分别与氟气化合形成物质X、Y、Z熔点见下表:
| 氟化物 | X | Y | Z |
| 熔点/K | 1266 | 1534 | 183 |
(3)已知常温条件下,极性分子DOE2是一种液态化合物,中心原子D的杂化方式是
(4)G与氮原子可1:1化合,形成人工合成的新型半导体材料,其晶体结构与单晶硅相似.G原子的价电子排布式为
(5)F晶体的堆积方式是