题目内容
[化学选修-物质结构与性质]
元素周期律是20世纪科学技术发展的重要理论依据之一.已知A、B、C、D、E五种元素都是元素周期表中前20号元素.A、B、C、D四种元素在元素周期表(长式)中的相对位置如下图所示,B、C、D的最高价氧化物的水化物两两混合,均能发生反应生成盐和水.E元素的原子序数均大于A、B、C、D元素,且不与A、B、C、D元素位于同主族.
根据以上信息,回答下列问题:
(1)上述A、B、C、D四种元素中第一电离能最小的是 ,电负性最大的是 .(填相关元素的元素符号)
(2)A和D的氢化物中,沸点较高的是 (填相关物质的分子式);其原因是 .
(3)A和E可组成离子化合物,其晶胞(在晶体中具有代表性的最小重复单元)结构如下图所示:
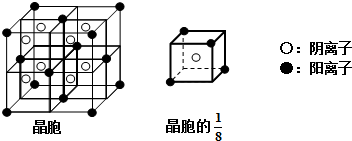
阳离子位于该正方体的顶点或面心;阴离子均位于小正方体中心.该化合物化学式为 .
元素周期律是20世纪科学技术发展的重要理论依据之一.已知A、B、C、D、E五种元素都是元素周期表中前20号元素.A、B、C、D四种元素在元素周期表(长式)中的相对位置如下图所示,B、C、D的最高价氧化物的水化物两两混合,均能发生反应生成盐和水.E元素的原子序数均大于A、B、C、D元素,且不与A、B、C、D元素位于同主族.
| … | A | |||||
| B | C | D |
(1)上述A、B、C、D四种元素中第一电离能最小的是
(2)A和D的氢化物中,沸点较高的是
(3)A和E可组成离子化合物,其晶胞(在晶体中具有代表性的最小重复单元)结构如下图所示:

阳离子位于该正方体的顶点或面心;阴离子均位于小正方体中心.该化合物化学式为
分析:已知A、B、C、D、E五种元素都是元素周期表中前20号元素,B、C、D的最高价氧化物的水化物两两混合,均能发生反应生成盐和水,为氢氧化铝与强碱、强酸的反应,由元素在周期表中的相对位置可知,C为Al元素,故B为Na元素、D为S元素、A为F元素,E元素的原子序数均大于A、B、C、D元素,且不与A、B、C、D元素位于同主族,则E为Ca元素,据此解答.
解答:解:已知A、B、C、D、E五种元素都是元素周期表中前20号元素,B、C、D的最高价氧化物的水化物两两混合,均能发生反应生成盐和水,为氢氧化铝与强碱、强酸的反应,由元素在周期表中的相对位置可知,C为Al元素,故B为Na元素、D为S元素、A为F元素,E元素的原子序数均大于A、B、C、D元素,且不与A、B、C、D元素位于同主族,则E为Ca元素,
(1)同周期自左而右第一电离能呈增大趋势,同主族自上而下第一电离能逐渐减小,金属性越强电离能越小,故电离能F>S>Al>Na>Ca,非金属性越强电负性越大,故F的电负性最大,故答案为:Ca;F;
(2)A和D的氢化物分别为HF、H2S,HF分子间存在氢键,HF的沸点较高,故答案为:HF;HF分子间存在氢键;
(3)F和Ca组成离子化合物,晶胞中钙离子位于该正方体的顶点或面心,晶胞中钙离子数目为8×
+6×
=4,氟离子均位于小正方体中心,晶胞中氟离子数目为8,故该化合物化学式为CaF2,
故答案为:CaF2.
(1)同周期自左而右第一电离能呈增大趋势,同主族自上而下第一电离能逐渐减小,金属性越强电离能越小,故电离能F>S>Al>Na>Ca,非金属性越强电负性越大,故F的电负性最大,故答案为:Ca;F;
(2)A和D的氢化物分别为HF、H2S,HF分子间存在氢键,HF的沸点较高,故答案为:HF;HF分子间存在氢键;
(3)F和Ca组成离子化合物,晶胞中钙离子位于该正方体的顶点或面心,晶胞中钙离子数目为8×
| 1 |
| 8 |
| 1 |
| 2 |
故答案为:CaF2.
点评:本题考查物质结构与性质,涉及元素化合物推断、电离能、电负性、氢键、晶胞计算等,难度不大,推断元素是关键,氢氧化铝的性质是推断突破口.

练习册系列答案
相关题目
 (2011?新余二模)化学--选修物质结构与性质
(2011?新余二模)化学--选修物质结构与性质
 [化学-选修物质结构与性质]
[化学-选修物质结构与性质]