题目内容
 [化学-选修物质结构与性质]
[化学-选修物质结构与性质]Q、R、X、Y、Z为周期表前四周期元素,原子序数依次递增.已知:
①Q为周期表中原子半径最小的元素;
②R的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;
③Y的基态原子的核外成对电子数是未成对电子数的3倍;
④Z有“生物金属”之称,Z4+离子和氩原子的核外电子排布相同.
请回答下列问题:(答题时,Q、R、X、Y、Z用所对应的元素符号表示)
(1)RQ4Y分子的某中心原子采用的杂化轨道类型是
sp3
sp3
杂化.(2)R、X、Y三种元素的第一电离能由小到大的顺序为
C<O<N
C<O<N
.(3)已知:原子数目和电子总数(或价电子总数)相同的微粒互为等电子体,等电子体具有相似的结构特征.与RY分子互为等电子体的分子和离子分别为
N2
N2
和CN-
CN-
(填化学式).(4)Z元素位于周期表的
d
d
分区.Z原子基态时的外围电子排布式为3d24s2
3d24s2
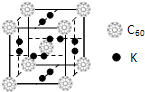
,Z的一种含氧酸钡盐的晶胞结构如图所示,晶体内与每个“Z”原子等距离且最近的氧原子数为6
6
.分析:①Q为周期表中原子半径最小的元素,应为H元素;
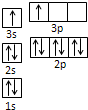
②R的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,核外电子排布式为1s22s22p2,应为C元素;
③Y的基态原子的核外成对电子数是未成对电子数的3倍,核外电子排布式为1s22s22p4,应为O元素;
④Z有“生物金属”之称,Z4+离子和氩原子的核外电子排布相同,原子序数为22,应为Ti元素;
Q、R、X、Y原子序数依次递增,则X为N元素,结合原则的结构、对应单质、化合物的性质以及元素周期律知识解答该题.
②R的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,核外电子排布式为1s22s22p2,应为C元素;
③Y的基态原子的核外成对电子数是未成对电子数的3倍,核外电子排布式为1s22s22p4,应为O元素;
④Z有“生物金属”之称,Z4+离子和氩原子的核外电子排布相同,原子序数为22,应为Ti元素;
Q、R、X、Y原子序数依次递增,则X为N元素,结合原则的结构、对应单质、化合物的性质以及元素周期律知识解答该题.
解答:解:①Q为周期表中原子半径最小的元素,应为H元素;
②R的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,核外电子排布式为1s22s22p2,应为C元素;
③Y的基态原子的核外成对电子数是未成对电子数的3倍,核外电子排布式为1s22s22p4,应为O元素;
④Z有“生物金属”之称,Z4+离子和氩原子的核外电子排布相同,原子序数为22,应为Ti元素;
Q、R、X、Y原子序数依次递增,则X为N元素,则
(1)分子式为RQ4Y的物质为CH3OH,C原子形成4个δ键,为sp3杂化,故答案为:sp3;
(2)同周期元素从左到右元素的第一电离能逐渐减小,则C元素的最小,由于N的2p轨道电子为半充满状态,难以失去电子,第一电离能大于O,所以第一电离能从小到大的顺序为:C<O<N,
故答案为:C<O<N;
(3)CO的电子数为14,N2和 CN-电子数也为14,且都含有2个原子,三者为等电子体,故答案为:N2; CN-;
(4)Z的原子序数为22,为Ti元素位于周期表第四周期ⅣB族,在d区,外围电子排布式为3d24s2,晶胞中Ti位于晶胞的顶点,与之距离最近的O原子位于晶胞的棱上,应有6个,
故答案为:d;3d24s2; 6.
②R的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,核外电子排布式为1s22s22p2,应为C元素;
③Y的基态原子的核外成对电子数是未成对电子数的3倍,核外电子排布式为1s22s22p4,应为O元素;
④Z有“生物金属”之称,Z4+离子和氩原子的核外电子排布相同,原子序数为22,应为Ti元素;
Q、R、X、Y原子序数依次递增,则X为N元素,则
(1)分子式为RQ4Y的物质为CH3OH,C原子形成4个δ键,为sp3杂化,故答案为:sp3;
(2)同周期元素从左到右元素的第一电离能逐渐减小,则C元素的最小,由于N的2p轨道电子为半充满状态,难以失去电子,第一电离能大于O,所以第一电离能从小到大的顺序为:C<O<N,
故答案为:C<O<N;
(3)CO的电子数为14,N2和 CN-电子数也为14,且都含有2个原子,三者为等电子体,故答案为:N2; CN-;
(4)Z的原子序数为22,为Ti元素位于周期表第四周期ⅣB族,在d区,外围电子排布式为3d24s2,晶胞中Ti位于晶胞的顶点,与之距离最近的O原子位于晶胞的棱上,应有6个,
故答案为:d;3d24s2; 6.
点评:本题考查较为综合,题目难度中等,正确推断元素的种类为解答该题的关键,本题易错点为(4),注意与Ti位于同一平面的O有4个,上下延伸,各有1个,共6个.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 (2011?新余二模)化学--选修物质结构与性质
(2011?新余二模)化学--选修物质结构与性质