网址:http://m.1010jiajiao.com/timu3_id_411967[举报]
氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为(MgCO3,舍少量FeCO3)为原料制备高纯氧化镁的实验流程如下:

(1)通入O2氧化时,发生反应的离子方程式为____________________。
(2)滤渣2的成分是_________(填化学式)
(3)流程图中“操作步骤”为??????????????????????? 、过滤等操作,得到MgSO4·7H2O晶体。对MgSO4·7H2O晶体直接加热??????? (填“能”或“不能”)得到无水MgSO4固体。
(4)长时间加热MgCO3悬浊液后生成Mg(OH)2,该反应的化学方程式为?????????????????????????????????? 。
(5)已知酸碱指示剂百里酚蓝变色的pH范围如表所示:
pH | < 8.0 | 8.0 ~ 9.6 | > 9.6 |
颜色 | 黄色 | 绿色 | 蓝色 |
25℃时,向Mg(OH)2的饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为???????????????? ? [25℃时,Mg(OH)2的溶度积Ksp=5.6×10-12)]。
(6)煅烧过程存在以下反应:
2MgSO4+C 2MgO+2SO2↑+CO2↑; MgSO4+C
2MgO+2SO2↑+CO2↑; MgSO4+C MgO+SO2↑+CO↑;
MgO+SO2↑+CO↑;
MgSO4+3C MgO+S↑+3CO↑。
MgO+S↑+3CO↑。
①若在实验室中煅烧硫酸镁,需要的仪器除酒精灯、三脚架以外,还需要?? ? ??? 。
A.蒸发皿????? B.坩埚??????? C.泥三角??????? D.石棉网
②用下列实验装置检验煅烧产生的气体中含有SO2、CO2气体(加热装置略去,部分装置可以重复使用)。

正确的连接顺序是a→b→??????????????????????? (按接口连接)。B中盛放的试剂是???????????????? ,确定存在二氧化碳气体的实验现象是????????????????????????? 。
查看习题详情和答案>>
氧化铁是重要工业颜料。工业上通常以废铁屑(杂质不与酸反应)为原料制备FeCO3,再将其煅烧制取氧化铁。工业制备FeCO3的流程如下:
回答下列问题:
(1)操作Ⅰ的名称是 。
(2)写出生成FeCO3沉淀的离子方程式 。
(3)有些同学认为滤液Ⅰ中铁元素含量可用KMnO4溶液来测定(5Fe2++MnO-4+8H+=5Fe3++Mn2++4H2O)。
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的玻璃仪器除玻璃棒、烧杯、胶头滴管外,还需 。
②某同学设计了下列滴定方式(夹持部分略去),最合理的是 。(填字母序号)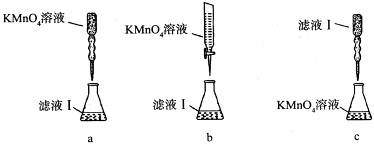
(4)该流程中用到的Na2CO3在工业生产中常含有少量NaCl。某校化学活动社团设计如图所示装置来测定Na2CO3的含量。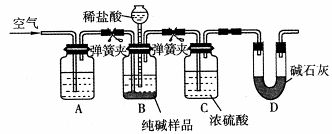
①要检验Na2CO3中杂质的存在,选用下列试剂中的 (选填序号)。
a.氢氧化钡溶液 b.稀硝酸 c.硫氰酸钾溶液 d.硝酸银溶液
②检验装置B气密性的方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后静置,若 ,说明装置不漏气。
③装置A中的试剂 ,装置C的作用 。
④以上实验装置存在明显缺陷,该缺陷导致测定结果偏高,该缺陷为 。
氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为(MgCO3,舍少量FeCO3)为原料制备高纯氧化镁的实验流程如下:
(1)通入O2氧化时,发生反应的离子方程式为____________________。
(2)滤渣2的成分是_________(填化学式)
(3)流程图中“操作步骤”为 、过滤等操作,得到MgSO4·7H2O晶体。对MgSO4·7H2O晶体直接加热 (填“能”或“不能”)得到无水MgSO4固体。
(4)长时间加热MgCO3悬浊液后生成Mg(OH)2,该反应的化学方程式为 。
(5)已知酸碱指示剂百里酚蓝变色的pH范围如表所示:
| pH | < 8.0 | 8.0 ~ 9.6 | > 9.6 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
(6)煅烧过程存在以下反应:
2MgSO4+C
 2MgO+2SO2↑+CO2↑; MgSO4+C
2MgO+2SO2↑+CO2↑; MgSO4+C MgO+SO2↑+CO↑;
MgO+SO2↑+CO↑;MgSO4+3C
 MgO+S↑+3CO↑。
MgO+S↑+3CO↑。①若在实验室中煅烧硫酸镁,需要的仪器除酒精灯、三脚架以外,还需要 。
A.蒸发皿 B.坩埚 C.泥三角 D.石棉网
②用下列实验装置检验煅烧产生的气体中含有SO2、CO2气体(加热装置略去,部分装置可以重复使用)。

正确的连接顺序是a→b→ (按接口连接)。B中盛放的试剂是 ,确定存在二氧化碳气体的实验现象是 。 查看习题详情和答案>>
(Ⅰ)下列一组有水参与的反应:
①2Na+2H2O=2NaOH+H2↑
②2Na2O2+2H2O=4NaOH+O2↑
③Na2O+H2O=2NaOH
④3Fe+4H2O
| ||
⑤2H2O
| ||
⑥2F2+2H2O=4HF+O2
(1)其中不属于氧化还原反应的是______(填编号)
(2)在这些氧化还原反应中,水只作氧化剂的反应是______(填编号)
水只作还原剂的反应是______(填编号)水既作氧化剂,又作还原剂是______(填编号)
水既不作氧化剂,又不作还原剂是______(填编号)
(3)根据你的理解,氧化还原反应的实质是______
A.分子中的原子重新组合 B.氧元素的得失
C.电子的得失或共用电子对的偏移 D.化合价的改变
(4)请你运用所学知识分析3NO2+H2O=2HNO3+NO是否属于氧化还原反应?______(填“是”或“不是”),若是,这个反应的氧化剂是______,还原剂是______.
(Ⅱ)写出下列反应的离子方程式:
①往氯化铁溶液加入铁粉:______
②过量二氧化碳通入澄清石灰水:______
③往氯化铝溶液中加入足量的NaOH溶液:______
(Ⅲ)写出下列反应的化学方程式:
①二氧化硫发生催化氧化反应:______
②氯气与氢氧化钠溶液反应:______
③铜片与稀硝酸的反应:______.
回答下列问题:
(1)操作Ⅰ的名称是 。
(2)写出生成FeCO3沉淀的离子方程式 。
(3)有些同学认为滤液Ⅰ中铁元素含量可用KMnO4溶液来测定(5Fe2++MnO-4+8H+=5Fe3++Mn2++4H2O)。
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的玻璃仪器除玻璃棒、烧杯、胶头滴管外,还需 。
②某同学设计了下列滴定方式(夹持部分略去),最合理的是 。(填字母序号)

(4)该流程中用到的Na2CO3在工业生产中常含有少量NaCl。某校化学活动社团设计如图所示装置来测定Na2CO3的含量。
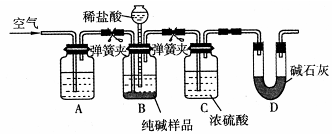
①要检验Na2CO3中杂质的存在,选用下列试剂中的 (选填序号)。
a.氢氧化钡溶液 b.稀硝酸 c.硫氰酸钾溶液 d.硝酸银溶液
②检验装置B气密性的方法是:塞紧带长颈漏斗的三孔橡胶塞,夹紧弹簧夹后,从漏斗注入一定量的水,使漏斗内的水面高于瓶内的水面,停止加水后静置,若 ,说明装置不漏气。
③装置A中的试剂 ,装置C的作用 。
④以上实验装置存在明显缺陷,该缺陷导致测定结果偏高,该缺陷为 。