题目内容
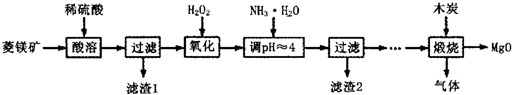
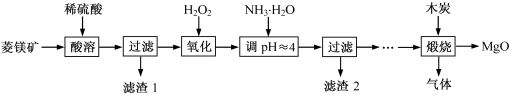
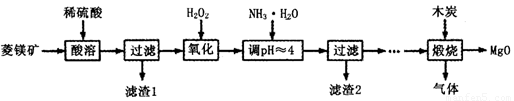
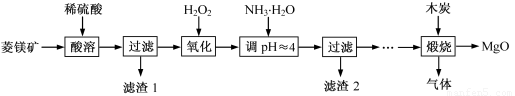
氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为(MgCO3,舍少量FeCO3)为原料制备高纯氧化镁的实验流程如下:

(1)通入O2氧化时,发生反应的离子方程式为____________________。
(2)滤渣2的成分是_________(填化学式)
(3)流程图中“操作步骤”为??????????????????????? 、过滤等操作,得到MgSO4·7H2O晶体。对MgSO4·7H2O晶体直接加热??????? (填“能”或“不能”)得到无水MgSO4固体。
(4)长时间加热MgCO3悬浊液后生成Mg(OH)2,该反应的化学方程式为?????????????????????????????????? 。
(5)已知酸碱指示剂百里酚蓝变色的pH范围如表所示:
pH | < 8.0 | 8.0 ~ 9.6 | > 9.6 |
颜色 | 黄色 | 绿色 | 蓝色 |
25℃时,向Mg(OH)2的饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为???????????????? ? [25℃时,Mg(OH)2的溶度积Ksp=5.6×10-12)]。
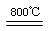
(6)煅烧过程存在以下反应:
2MgSO4+C 2MgO+2SO2↑+CO2↑; MgSO4+C
2MgO+2SO2↑+CO2↑; MgSO4+C MgO+SO2↑+CO↑;
MgO+SO2↑+CO↑;
MgSO4+3C MgO+S↑+3CO↑。
MgO+S↑+3CO↑。
①若在实验室中煅烧硫酸镁,需要的仪器除酒精灯、三脚架以外,还需要?? ? ??? 。
A.蒸发皿????? B.坩埚??????? C.泥三角??????? D.石棉网
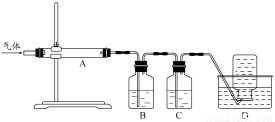
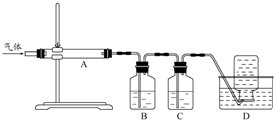
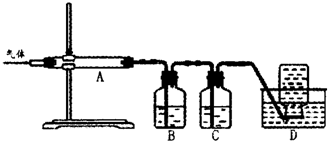
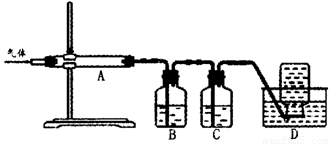
②用下列实验装置检验煅烧产生的气体中含有SO2、CO2气体(加热装置略去,部分装置可以重复使用)。

正确的连接顺序是a→b→??????????????????????? (按接口连接)。B中盛放的试剂是???????????????? ,确定存在二氧化碳气体的实验现象是????????????????????????? 。
(1)4Fe2++O2+4H+=4Fe3++2 H2O(2分) (2)Fe(OH)3 (2分)
(3)蒸发浓缩、冷却结晶? (2分,少选一个扣1分) ?? 能? (1分)
(4)MgCO3+H2O= Mg(OH)2+CO2↑(2分)
(5)蓝色(2分)
(6)①B? C (2分,少选一个扣1分)?
②dcabfge(或dcfge)(2分,少选、错选不得分)?? 酸性高锰酸钾溶液(2分)
后A中品红不褪色,澄清石灰水变浑浊(或B中颜色变浅,澄清石灰水变浑浊)(2分)
【解析】
试题分析:(1)菱镁矿与硫酸反应生成Fe2+,通入氧气,把Fe2+氧化为Fe3+,离子方程式为:4Fe2++O2+4H+=4Fe3++2 H2O
(2)调节pH至4,Fe3+转化为Fe(OH)3,所以滤渣2的成分是Fe(OH)3。
(3)从MgSO4溶液得到MgSO4·7H2O晶体,先加热蒸发水分,使MgSO4溶液浓度变大,然后降温,MgSO4的溶解度减小,析出MgSO4·7H2O晶体,所以流程图中“操作步骤”为:蒸发浓缩、冷却结晶;将MgSO4?7H2O晶体直接加热会造成结晶水脱去,硫酸镁较稳定,可以稳定存在,所以对MgSO4·7H2O晶体直接加热能得到无水MgSO4固体。
(4)长时间加热MgCO3悬浊液后生成Mg(OH)2,化学方程式为:MgCO3+H2O= Mg(OH)2+CO2↑
(5)根据Mg(OH)2的溶度积Ksp=5.6×10-12,可得c(Mg2+)?c2(OH?)= 5.6×10-12,c (OH?)=2 c(Mg2+),可得c3(OH?)=2.246×10-11,可估算出pH>10,故溶液呈现蓝色。
(6)①煅烧固体物质的仪器为坩埚,坩埚需要在放在泥三角上加热,故答案为BC。
②B中溶液的作用为除去SO2,防止干扰CO2的检验,所以B中溶液为:酸性高锰酸钾溶液;首先连接dc,连接ab,品红的作用是证明SO2已完全被除去,在连接fg,用澄清石灰水检验CO2,所以连接顺序为:dcabfge(或dcfge);后A中品红不褪色或B中颜色变浅,,说明SO2已完全除去,澄清石灰水变浑浊,则可证明气体中含CO2.
考点:本题考查化学流程的分析、方程式的书写、基本操作和基本仪器、溶度积的计算、气体的检验。

 灵星计算小达人系列答案
灵星计算小达人系列答案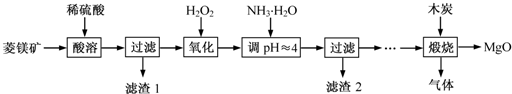
 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑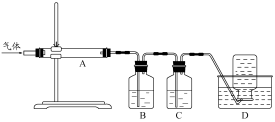

 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑