摘要:1.忽视实验过程中的隐蔽性操作.对装置观察不仔细而造成答题失误.
网址:http://m.1010jiajiao.com/timu3_id_40374[举报]
用右图所示装置进行中和热测定实验,请回答问题:
(1)大小烧杯之间填满碎泡沫塑料的作用是
(2)使用补全仪器后的装置进行实验,取50mL0.25mol/LH2SO4溶液与50mL0.55mol/LNaOH溶液在小烧杯中进行中和反应,三次实验温度平均升高3.4℃.已知中和后生成的溶液的比热容为4.18J/(g?℃),溶液的密度均为1g/cm3.通过计算可得中和热△H=
H2SO4(aq)+NaOH(aq)=Na2SO4(aq)+H2O(l),△H=-56.8KJ/mol
H2SO4(aq)+NaOH(aq)=Na2SO4(aq)+H2O(l),△H=-56.8KJ/mol.
(3)实验中若用60mL0.25mol?L-1H2SO4溶液跟50mL0.55mol?L-1NaOH溶液进行反应,与上述实验相比,所放出的热量
查看习题详情和答案>>
(1)大小烧杯之间填满碎泡沫塑料的作用是
保温、隔热、减少实验过程中的热量散失
保温、隔热、减少实验过程中的热量散失
,从实验装置上看,图中缺少的一种玻璃仪器是环形玻璃搅拌器
环形玻璃搅拌器
.(2)使用补全仪器后的装置进行实验,取50mL0.25mol/LH2SO4溶液与50mL0.55mol/LNaOH溶液在小烧杯中进行中和反应,三次实验温度平均升高3.4℃.已知中和后生成的溶液的比热容为4.18J/(g?℃),溶液的密度均为1g/cm3.通过计算可得中和热△H=
-56.8KJ/mol
-56.8KJ/mol
,H2SO4与NaOH反应的热化学方程式为| 1 |
| 2 |
| 1 |
| 2 |
(3)实验中若用60mL0.25mol?L-1H2SO4溶液跟50mL0.55mol?L-1NaOH溶液进行反应,与上述实验相比,所放出的热量
不相等
不相等
(填“相等”、“不相等”),所求中和热相等
相等
(填“相等”、“不相等”);,若用50mL0.50mol?L-1醋酸代替H2SO4溶液进行上述实验,测得反应前后温度的变化值会偏小
偏小
(填“偏大”、“偏小”、“不受影响”).进行中和热的测定的装置如图所示.回答下列问题:
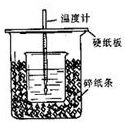
(1)从实验装置中尚缺少的一种玻璃用品是
(2)烧杯间填满碎纸条的作用是
(3)利用该装置测得的中和热数值
(4)某研究小组将装置完善后,把V1 mL 1.0mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).回答下列问题:

①研究小组做该实验时环境温度
②由题干及图形可知,V1/V2=
查看习题详情和答案>>

(1)从实验装置中尚缺少的一种玻璃用品是
环形玻璃搅拌器
环形玻璃搅拌器
.(2)烧杯间填满碎纸条的作用是
减少实验过程中的热量损失
减少实验过程中的热量损失
.(3)利用该装置测得的中和热数值
偏小
偏小
(填“偏大、偏小、无影响”)(4)某研究小组将装置完善后,把V1 mL 1.0mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).回答下列问题:

①研究小组做该实验时环境温度
低于
低于
(填“高于”、“低于”或“等于”)22℃.②由题干及图形可知,V1/V2=
3:2
3:2
时,酸碱恰好完全中和,此反应所用NaOH溶液的浓度应为1.5
1.5
mol/L. 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:(1)从实验装置上看,图中尚缺少的一种玻璃仪器是
环形玻璃搅拌棒
环形玻璃搅拌棒
.(2)烧杯间填满碎纸条的作用是
减少实验过程中的热量损失
减少实验过程中的热量损失
.(3)要重复进行三次实验的目的是
多次测量求平均值可以减少实验误差
多次测量求平均值可以减少实验误差
.(4)大烧杯上如不盖硬纸板,求得的中和热数值
偏小
偏小
(填“偏大、偏小、无影响”);当室温低于10℃时进行,对实验结果会造成较大的误差,其原因是室温较低时反应体系向环境散热比较快,热量损失大,结果偏低
室温较低时反应体系向环境散热比较快,热量损失大,结果偏低
(5)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量
不相等
不相等
(填“相等、不相等”),所求中和热相等
相等
(填“相等、不相等”),简述理由因为中和热是指酸跟碱发生中和反应生成nmolH2O所放出的热量,与酸碱的用量无关
因为中和热是指酸跟碱发生中和反应生成nmolH2O所放出的热量,与酸碱的用量无关
.(6)用相同浓度和体积的醋酸(CH3COOH)代替HCl溶液进行上述实验,测得的中和热的数值会
偏小
偏小
;(填“偏大、偏小、无影响”).(7)三次平行操作所测得的数据如下:
| 温度 序号 |
起始温度t1/℃ | 终止温度 T2/℃ |
温度差 △t/℃ | ||
| HCl | NaOH | 平均值 | |||
| 1 | 25 | 25 | 27.3 | ||
| 2 | 25 | 25 | 27.4 | ||
| 3 | 25 | 25 | 28.6 | ||
46.3kJ?mol-1
46.3kJ?mol-1
.用已知物质的量浓度的酸(或碱)来滴定未知物质的量浓度的碱(或酸)的方法叫酸碱中和滴定.中和滴定实验是以指示剂的变色来表示反应终点的到达.
(1)某学生中和滴定实验的过程如下:
①取一支碱式滴定管;
②用蒸馏水洗净;
③加入待测的NaOH溶液;
④调节起始读数,准确读取读数并记录;
⑤用酸式滴定管精确放出一定量标准酸液;
⑥置于未经标准酸液润洗的洁净锥形瓶中;
⑦加入2滴酚酞试液;
⑧开始滴定,边滴边摇荡;
⑨边注视滴定管内液面变化;
⑩当小心滴到溶液由无色变成粉红色时,即停止滴定;
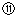 记录液面刻度的读数;
记录液面刻度的读数;
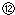 根据滴定管的两次读数得出NaOH溶液的体积为22mL
根据滴定管的两次读数得出NaOH溶液的体积为22mL
指出上述实验过程中的错误之处(填序号) .
(2)现以0.1000mol?L-1 NaOH溶液滴定20.00mL 0.1000mol?L-1HCl溶液为例,讨论强碱滴定强酸的情况,通过计算完成下表(已知:lg2=0.3,lg5=0.7.溶液混合时的体积变化忽略不计):
(3)请利用表的数据绘制滴定曲线.
(4)中和滴定过程中有好多技术问题要学会处理,如:读数时要平视.如果初读数和末读数如图所示,滴定液的用量为 mL.
查看习题详情和答案>>
(1)某学生中和滴定实验的过程如下:
①取一支碱式滴定管;
②用蒸馏水洗净;
③加入待测的NaOH溶液;
④调节起始读数,准确读取读数并记录;
⑤用酸式滴定管精确放出一定量标准酸液;
⑥置于未经标准酸液润洗的洁净锥形瓶中;
⑦加入2滴酚酞试液;
⑧开始滴定,边滴边摇荡;
⑨边注视滴定管内液面变化;
⑩当小心滴到溶液由无色变成粉红色时,即停止滴定;
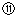 记录液面刻度的读数;
记录液面刻度的读数;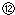 根据滴定管的两次读数得出NaOH溶液的体积为22mL
根据滴定管的两次读数得出NaOH溶液的体积为22mL指出上述实验过程中的错误之处(填序号)
(2)现以0.1000mol?L-1 NaOH溶液滴定20.00mL 0.1000mol?L-1HCl溶液为例,讨论强碱滴定强酸的情况,通过计算完成下表(已知:lg2=0.3,lg5=0.7.溶液混合时的体积变化忽略不计):
| 加入NaOH溶液的体积V/mL | 0.00 | 18.00 | 19.80 | 19.98 | 20.00 | 20.02 | 20.20 | 22.00 | 40.00 |
| 剩余盐酸溶液的体积V/mL | 20.00 | 2.00 | 0.20 | 0.02 | 0.00 | / | / | / | / |
| 过量NaOH溶液的体积V/mL | / | / | / | / | / | 0.02 | 0.20 | 2.00 | 20.00 |
| pH | 1.00 | 2.28 | 3.30 | 7.00 | 9.70 | 11.70 | 12.50 |

(4)中和滴定过程中有好多技术问题要学会处理,如:读数时要平视.如果初读数和末读数如图所示,滴定液的用量为
