摘要:17.(1)下列操作会导致实验值较实际值的是 . A.测定硫酸铜晶体中结晶水含量时.将加热后的坩埚置于干燥器中冷却后再称量 B.中和热测定实验中以环形铁丝搅拌棒代替环形玻璃搅拌棒 C.酸碱中和滴定实验中.将待测NaOH溶液装于碱式滴定管.标准HCl溶液盛于锥形瓶.进行滴定 D.配制100 mL2 mol/L的NaCl溶液.以胶头滴管加水定容时.液面稍超出容量瓶刻度线.反复摇匀后.凹液面最低点恰好与刻度线平齐 乙二酸俗称草酸.常见的草酸晶体是含有两分子结晶水的无色晶体(H2C2O4·2H2O).现有某同学欲加热草酸晶体制取CO. (1)写出反应的方程式: , (2)该同学拟用如下图如示的仪器A.B和胶管组成装置收集CO气体(①仪器A已经气密性检查,②装置可以重复使用) 则该收集装置的连接顺序为: . 此外.完成CO气体收集除水外还需要 试剂.
网址:http://m.1010jiajiao.com/timu3_id_397909[举报]
信息时代给人们的生活带来了极大的便利,但同时也产生了大量的电子垃圾.某化学兴趣小组将一批废弃的线路板简单处理后,得到了主要含Cu、Al及少量Fe、Au等金属的混合物,并设计了如下制备硫酸铜晶体和硫酸铝晶体的路线:
部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)过滤操作中用到的玻璃仪器有
(2)Cu可溶于稀硫酸与H2O2的混合溶液,其离子方程式是
(3)滤渣a的主要成分是
(4)步骤③中X的取值范围是
(5)某小组甲同学提出如下方案测定CuSO4?5H2O晶体的纯度.取b g试样配成100m L溶液,每次取20.00m L,消除干扰离子后,用c mol?L-1EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液12.00m L.滴定反应如下:Cu2++H2Y2-═CuY2-+2H+.
①写出计算CuSO4?5H2O质量分数的表达式w=
.
②下列操作会导致CuSO4?5H2O含量的测定结果偏高的是
a.未干燥锥形瓶 b.滴定终点时滴定管尖嘴中产生气泡c.未除净可与EDTA反应的干扰离子
③该小组乙同学提出通过直接测定样品中SO42一的量也可求得硫酸铜晶体的纯度,老师审核后予以否决,其原因是
查看习题详情和答案>>

部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 |
| 开始沉淀物 | 1.1 | 4.0 | 5.4 |
| 完全沉淀物 | 3.2 | 5.2 | 6.7 |
烧杯、漏斗、玻璃棒
烧杯、漏斗、玻璃棒
.(2)Cu可溶于稀硫酸与H2O2的混合溶液,其离子方程式是
Cu+H2O2+2H+═Cu2++2H2O
Cu+H2O2+2H+═Cu2++2H2O
.(3)滤渣a的主要成分是
Au
Au
.(4)步骤③中X的取值范围是
5.2≤X<5.4
5.2≤X<5.4
.(5)某小组甲同学提出如下方案测定CuSO4?5H2O晶体的纯度.取b g试样配成100m L溶液,每次取20.00m L,消除干扰离子后,用c mol?L-1EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液12.00m L.滴定反应如下:Cu2++H2Y2-═CuY2-+2H+.
①写出计算CuSO4?5H2O质量分数的表达式w=
| 15c |
| a |
| 15c |
| a |
②下列操作会导致CuSO4?5H2O含量的测定结果偏高的是
c
c
(填字母).a.未干燥锥形瓶 b.滴定终点时滴定管尖嘴中产生气泡c.未除净可与EDTA反应的干扰离子
③该小组乙同学提出通过直接测定样品中SO42一的量也可求得硫酸铜晶体的纯度,老师审核后予以否决,其原因是
样品中的杂质Na2SO4中也含有SO42-
样品中的杂质Na2SO4中也含有SO42-
. 加碘食盐是在食盐中添加碘酸钾,当食盐含碘量(以I计算)超过20~50mg/kg,将对人体造成危害,所以检测食盐含碘量是保障加碘食盐质量的一项重要工作.某学生在实验室测定食用精制盐是否含碘及测定含碘量,主要反映为:
加碘食盐是在食盐中添加碘酸钾,当食盐含碘量(以I计算)超过20~50mg/kg,将对人体造成危害,所以检测食盐含碘量是保障加碘食盐质量的一项重要工作.某学生在实验室测定食用精制盐是否含碘及测定含碘量,主要反映为:(1)IO3-+5I-+6H+→3I2+3H2O
(2)I2+2S2O32-═2I-+S4O62-
具体步骤为:
a.称取10.000g食盐,准确配成100mL溶液;
b.取上述试样溶液10.00mL,用稀硫酸酸化,加入2%KI溶液,使KIO3与KI反应完全.
c.以A试液为指示剂,用物质的量浓度为0.0001 mol?L-1的Na2S2O3溶液逐滴进行滴定.
当加入Na2S2O3溶液10.00mL时,滴定到达终点.
请完成下列填空
(1)定性判断精制食盐是否含碘,除水、稀硫酸、Na2S2O3溶液外,还需要的试剂是
(2)步骤a中需要用到的仪器为:烧杯、玻棒、胶头滴管、
(3)步骤b中要使KIO3与KI反应完全,加入的KI溶液必须
(4)步骤c中A试液是
(5)该食盐含碘量
(6)测定过程中,下列操作会导致最终所测得食盐含碘量偏高的是
a.精确配制100mL食盐溶液时,定容时仰视读数
b.精确配制100mL实验溶液时,烧杯未洗涤并转移洗液
c.滴定过程中,滴定管漏液在锥形瓶外
d.滴定前,滴定管下端尖嘴处由气泡,滴定后气泡消失.
 为维持人体血液中的血糖含量,在给病人输液时,通常用葡萄糖注射液,下图是医院给病人输液时使用的一瓶质量分数为5%的葡萄糖(C6H12O6)注射液的标签.某学生欲在实验室中配制500mL该葡萄糖注射液.
为维持人体血液中的血糖含量,在给病人输液时,通常用葡萄糖注射液,下图是医院给病人输液时使用的一瓶质量分数为5%的葡萄糖(C6H12O6)注射液的标签.某学生欲在实验室中配制500mL该葡萄糖注射液.实验用品:葡萄糖固体、蒸馏水、烧杯、容量瓶(500mL)、药匙、胶头滴管、量筒.
(1)还缺少的仪器有
托盘天平、玻璃棒
托盘天平、玻璃棒
.(2)下列对容量瓶及使用的描述中不正确的是
ACD
ACD
.A.容量瓶上标有容积、温度和浓度
B.使用前要检查容量瓶是否漏水
C.容量瓶用蒸馏水洗净后,再用5%葡萄糖注射液洗
D.配制溶液时,把称好的葡萄糖晶体小心倒入容量瓶中,加入蒸馏水到接近刻度线1~2cm处,改用胶头滴管加蒸馏水至刻度线
(3)实验中需取用固体的质量为
27.0
27.0
g,该葡萄糖注射液的物质的量浓度0.3
0.3
mol/L.(4)配制该葡萄糖注射液,下列操作会导致所配溶液的物质的量浓度偏高的是
B
B
.A.没有将洗涤液转移到容量瓶 B.定容时俯视刻度线
C.容量瓶洗净后未干燥 D.定容时液面超过了刻度线.
(2013?珠海一模)(1)小明在做“研究温度对反应速率的影响”实验时,他取了两只试管,均加入4mL 0.01mol/L的KMnO4酸性溶液和2mL 0.1mol/L H2C2O4(乙二酸)溶液,振荡,A试管置于热水中,B试管置于凉水中,记录溶液褪色所需的时间.
①需要用
②写出该反应的离子方程式
(2)实验室有瓶混有泥沙的乙二酸样品,小明利用这个反应的原理来测定其含量,具体操作 为:
①配制250mL溶液:准确称量5.0g乙二酸样品,配成250mL溶液.
②滴定:准确量取25.00mL所配溶液于锥形瓶中,加少量酸酸化,将0.1000mol?L-1KMnO4溶液装入
在实验中发现,刚滴下少量KMnO4溶液时,溶液迅速变成紫红色.将锥形瓶摇动一段时间后,紫红色慢慢消失;再继续滴加时,紫红色就很快褪色了.请解释原因:
③计算:再重复上述操作2次,记录实验数据如下.
则消耗KMnO4溶液的平均体积为
④误差分析:下列操作会导致测定结果偏高的是
A.未用标准浓度的酸性KMnO4溶液润洗滴定管
B.滴定前锥形瓶有少量水
C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
D.不小心将少量酸性KMnO4溶液滴在锥形瓶外
E.观察读数时,滴定前仰视,滴定后俯视.
查看习题详情和答案>>
①需要用
硫酸
硫酸
来酸化KMnO4溶液,褪色所需时间tA<
<
tB(填“>”、“=”或“<”).②写出该反应的离子方程式
5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O
5H2C2O4+2MnO4-+6H+=10CO2↑+2Mn2++8H2O
.(2)实验室有瓶混有泥沙的乙二酸样品,小明利用这个反应的原理来测定其含量,具体操作 为:
①配制250mL溶液:准确称量5.0g乙二酸样品,配成250mL溶液.
②滴定:准确量取25.00mL所配溶液于锥形瓶中,加少量酸酸化,将0.1000mol?L-1KMnO4溶液装入
酸式
酸式
(填“酸式”或“碱式”)滴定管,进行滴定操作.在实验中发现,刚滴下少量KMnO4溶液时,溶液迅速变成紫红色.将锥形瓶摇动一段时间后,紫红色慢慢消失;再继续滴加时,紫红色就很快褪色了.请解释原因:
反应中生成的锰离子具有催化作用,所以随后褪色会加快
反应中生成的锰离子具有催化作用,所以随后褪色会加快
.当当滴入最后一滴高锰酸钾溶液,锥形瓶内的颜色恰好变成紫红色且半分钟不变化
当滴入最后一滴高锰酸钾溶液,锥形瓶内的颜色恰好变成紫红色且半分钟不变化
,证明达到滴定终点.③计算:再重复上述操作2次,记录实验数据如下.
| 序号 | 滴定前读数(mL) | 滴定后读数(mL) |
| 1 | 0.00 | 20.10 |
| 2 | 1.00 | 20.90 |
| 3 | 0.00 | 21.10 |
20.00
20.00
mL,已知H2C2O4的相对分子质量为90,则此样品的纯度为90.00%
90.00%
.④误差分析:下列操作会导致测定结果偏高的是
ACD
ACD
.A.未用标准浓度的酸性KMnO4溶液润洗滴定管
B.滴定前锥形瓶有少量水
C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
D.不小心将少量酸性KMnO4溶液滴在锥形瓶外
E.观察读数时,滴定前仰视,滴定后俯视.
 (I)下列操作会导致实验结果偏高的是
(I)下列操作会导致实验结果偏高的是D
D
.A.配制一定物质的量浓度的硫酸溶液时,定容摇匀后,发现液面低于刻度线.
B.在配制一定物质的量浓度溶液时,用10ml的量筒量取5.0ml液体溶质时俯视读数
C.用天平称量20.5g某物质,砝码和药品的位置放反,所得药品的质量
D.10%的硫酸和90%的硫酸等体积混合配制50%的硫酸溶液
E.配制一定物质的量浓度溶液时,定容时仰视读数,所得溶液的浓度
(Ⅱ)现有下列仪器或用品:
a.铁架台(含铁圈、铁夹);b.锥形瓶;c.滴定管;d.烧杯(若干);e.玻璃棒;f.胶头滴管;g.托盘天平(含砝码);h.滤纸;i.量筒;j.漏斗;k.温度计.
试填空:
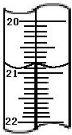
(1)如图所示分别是温度计、量筒、滴定管的一部分,下述判断及读数(虚线刻度)不正确的是
AD
AD
.A.①是量筒,读数为2.5mL
B.②是量筒,读数为2.5mL
C.③是滴定管,读数为2.50mL
D.②是温度计,读数是2.5℃
(2)用给出的仪器和NaOH固体配制一定物质的量浓度的氢氧化钠溶液时,还缺少的仪器有
钥匙、容量瓶
钥匙、容量瓶
;(3)用给出的仪器进行粗盐的提纯实验,还缺少的仪器有
蒸发皿、酒精灯
蒸发皿、酒精灯
.