题目内容
 加碘食盐是在食盐中添加碘酸钾,当食盐含碘量(以I计算)超过20~50mg/kg,将对人体造成危害,所以检测食盐含碘量是保障加碘食盐质量的一项重要工作.某学生在实验室测定食用精制盐是否含碘及测定含碘量,主要反映为:
加碘食盐是在食盐中添加碘酸钾,当食盐含碘量(以I计算)超过20~50mg/kg,将对人体造成危害,所以检测食盐含碘量是保障加碘食盐质量的一项重要工作.某学生在实验室测定食用精制盐是否含碘及测定含碘量,主要反映为:(1)IO3-+5I-+6H+→3I2+3H2O
(2)I2+2S2O32-═2I-+S4O62-
具体步骤为:
a.称取10.000g食盐,准确配成100mL溶液;
b.取上述试样溶液10.00mL,用稀硫酸酸化,加入2%KI溶液,使KIO3与KI反应完全.
c.以A试液为指示剂,用物质的量浓度为0.0001 mol?L-1的Na2S2O3溶液逐滴进行滴定.
当加入Na2S2O3溶液10.00mL时,滴定到达终点.
请完成下列填空
(1)定性判断精制食盐是否含碘,除水、稀硫酸、Na2S2O3溶液外,还需要的试剂是
(2)步骤a中需要用到的仪器为:烧杯、玻棒、胶头滴管、
(3)步骤b中要使KIO3与KI反应完全,加入的KI溶液必须
(4)步骤c中A试液是
(5)该食盐含碘量
(6)测定过程中,下列操作会导致最终所测得食盐含碘量偏高的是
a.精确配制100mL食盐溶液时,定容时仰视读数
b.精确配制100mL实验溶液时,烧杯未洗涤并转移洗液
c.滴定过程中,滴定管漏液在锥形瓶外
d.滴定前,滴定管下端尖嘴处由气泡,滴定后气泡消失.
分析:(1)根据题中反应原理及滴定过程判断,还需要指示剂淀粉和碘化钾溶液;
(2)注意称量的质量是10.000g食盐,必须使用电子天平,不能使用托盘天平;
(3)KIO3与KI反应完全,碘化钾溶液必须过量;根据滴定管的构造读出体积,必须读到0.01mL;
(4)反应原理设计了碘单质的反应,可以选用淀粉做指示剂;根据滴定终点的判断方法完成;
(5)根据反应方程式找出关系式IO3-~3I2~6S2O32-,计算出IO3-物质的量,就等于碘元素的物质的量,再计算出1kg食盐中含有的碘的质量;减少实验操作带来的误差,可以采用多次操作取平均值的方法;
(6)a、仰视读数,配制的溶液体积偏大,浓度偏小;
b、烧杯未洗涤并转移洗液,导致溶液中溶质的物质的量减小,配制的溶液浓度偏小;
c、滴定管漏液在锥形瓶外,消耗的标准液体积变大;
d、滴定前有气泡,导致消耗的标准液体积变大.
(2)注意称量的质量是10.000g食盐,必须使用电子天平,不能使用托盘天平;
(3)KIO3与KI反应完全,碘化钾溶液必须过量;根据滴定管的构造读出体积,必须读到0.01mL;
(4)反应原理设计了碘单质的反应,可以选用淀粉做指示剂;根据滴定终点的判断方法完成;
(5)根据反应方程式找出关系式IO3-~3I2~6S2O32-,计算出IO3-物质的量,就等于碘元素的物质的量,再计算出1kg食盐中含有的碘的质量;减少实验操作带来的误差,可以采用多次操作取平均值的方法;
(6)a、仰视读数,配制的溶液体积偏大,浓度偏小;
b、烧杯未洗涤并转移洗液,导致溶液中溶质的物质的量减小,配制的溶液浓度偏小;
c、滴定管漏液在锥形瓶外,消耗的标准液体积变大;
d、滴定前有气泡,导致消耗的标准液体积变大.
解答:解:(1)题中反应原理(1)IO3-+5I-+6H+→3I2+3H2O、(2)I2+2S2O32-═2I-+S4O62-,结合滴定过程,需要用淀粉做指示剂,还缺少碘化钾溶液,
故答案是:淀粉、KI溶液;
(2)根据质量要求达到0.001g,需要使用电子天平,还需要100mL容量瓶,
故答案是:100mL容量瓶、电子天平;
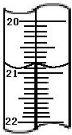
(3)加入的碘化钾溶液必须过量,才能使KIO3与KI反应完全;滴定管的每个小刻度线是0.10ml,两个滴定管读数相差0.10,读数应该是:20.80mL,
故答案是:过量;20.80;
(4)反应原理中有碘单质的反应,可以选用淀粉作为指示剂;滴定终点判断方法是:蓝色消失,半分钟保持不变,
故答案是:淀粉试液;蓝色消失,半分钟保持不变;
(5)有反应方程式:IO3-+5I-+6H+→3I2+3H2O、I2+2S2O32-═2I-+S4O62-,可得关系式:IO3-~3I2~6S2O32-,试样溶液10.00mL中:n(I)=n(IO3-)=
n(S2O32-)=
×0.0001 mol?L-1×(20.80-10.00)×10-3L=1.8×10-7mol,10.000g食盐含有的碘原子物质的量是10-3L=1.8×10-6mol,1000g食盐中含有的碘原子的质量是:127×1.8×10-6×100=22.86mg,多次操作取平均值可以减小误差,
故答案是:22.86;多次实验后取平均值;
(6)a、精确配制100mL食盐溶液时,定容时仰视读数,导致配制的溶液的体积偏大,溶液中溶质的浓度偏小,滴定时消耗的标准液偏少,测定结果偏低,故a错误;
b、精确配制100mL实验溶液时,烧杯未洗涤并转移洗液,配制的溶液溶质的物质的量减少,溶液中溶质的浓度偏小,滴定时消耗的标准液偏少,测定结果偏低,故b错误;
c、滴定过程中,滴定管漏液在锥形瓶外,消耗的标准液变大,测定结果偏高,故c正确;
d、滴定前,滴定管下端尖嘴处由气泡,滴定后气泡消失,导致消耗的标准液体积变大,测定结果偏高,故d正确;
故选cd.
故答案是:淀粉、KI溶液;
(2)根据质量要求达到0.001g,需要使用电子天平,还需要100mL容量瓶,
故答案是:100mL容量瓶、电子天平;
(3)加入的碘化钾溶液必须过量,才能使KIO3与KI反应完全;滴定管的每个小刻度线是0.10ml,两个滴定管读数相差0.10,读数应该是:20.80mL,
故答案是:过量;20.80;
(4)反应原理中有碘单质的反应,可以选用淀粉作为指示剂;滴定终点判断方法是:蓝色消失,半分钟保持不变,
故答案是:淀粉试液;蓝色消失,半分钟保持不变;
(5)有反应方程式:IO3-+5I-+6H+→3I2+3H2O、I2+2S2O32-═2I-+S4O62-,可得关系式:IO3-~3I2~6S2O32-,试样溶液10.00mL中:n(I)=n(IO3-)=
| 1 |
| 6 |
| 1 |
| 6 |
故答案是:22.86;多次实验后取平均值;
(6)a、精确配制100mL食盐溶液时,定容时仰视读数,导致配制的溶液的体积偏大,溶液中溶质的浓度偏小,滴定时消耗的标准液偏少,测定结果偏低,故a错误;
b、精确配制100mL实验溶液时,烧杯未洗涤并转移洗液,配制的溶液溶质的物质的量减少,溶液中溶质的浓度偏小,滴定时消耗的标准液偏少,测定结果偏低,故b错误;
c、滴定过程中,滴定管漏液在锥形瓶外,消耗的标准液变大,测定结果偏高,故c正确;
d、滴定前,滴定管下端尖嘴处由气泡,滴定后气泡消失,导致消耗的标准液体积变大,测定结果偏高,故d正确;
故选cd.
点评:本题考查了测定食盐中碘的含量方法,题量比较大,涉及了试剂选择、仪器选择、误差分析、含量计算等知识,注意合理分析题中信息,根据所学知识完成,本题难度中等.

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案
相关题目
食品安全问题是公众普遍关注的重点问题之一.下列做法中,不会危害人体健康的是( )
| A、不清不楚一滴香,清水变高汤 | B、不用熬,白水也能添成辣椒油 | C、在煲好的骨头汤中放入适量加碘食盐 | D、用塑料颗粒来制作珍珠奶茶中的“珍珠” |