摘要:28(10)A.B.C.D.E都是元素周期表中前20号元素.原子序数依次增大.A是非金属性最强的元素且A.D同主族,B.C.D同周期. B.C.D的最高价氧化物的水化物两两混合均能发生反应生成盐和水,E是第四周期主族元素.试回答: (1)写出E原子的核外电子排布式 (2)A和D氢化物中.沸点较高的是 ,A.B.C.D的离子中.半径由大到小的顺序是 . (3)元素C在元素周期表中的位置是第 周期. 族.元素C和D形成的化合物的晶体类型为 .该化合物易形成二聚分子.其结构式为 .C与D之间的成键方式为 .中心C原子采用 杂化. (4)A和E可组成离子化合物.其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如下图所示.阳离子位于该正方体的顶点和面心,阴离子均位于小正方体中心.该化合物是 . 晶胞 晶胞的1/8
网址:http://m.1010jiajiao.com/timu3_id_385145[举报]
(2009?淮安二模)饮用水安全状况与人类健康有着密切关系.重金属离子对河流、海洋会造成严重污染.沉淀法是处理含重金属离子污水常用的方法.
(1)通过控制溶液的pH对工业废水中的金属离子进行分离是实际工作中经常使用的分离方法.下图是某些金属氢氧化物在不同浓度和pH下的沉淀-溶解图.图中直线上的点表示一种平衡状态.通常认为残留在溶液中的离子浓度小于1×10-5mol?L-1时,该离子沉淀完全.
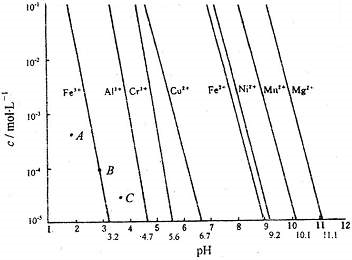
(1)则由上图可得Fe(OH)2的溶度积的值为
(2)上图中A、B、C三点中表示Fe(OH)3的沉淀速率大于溶解速率的是
(3)某工厂废水(pH=2.0,ρ=1.0g?mL-1)中含Ag+、Pb2+等 重金属离子,其浓度各约为0.01mol?L-1.排放前拟用沉淀法除去这两种离子,查找有关数据如下:
①你认为往废水中投入
A.NaOH B.Na2S C.KI D.Ca(OH)2
②如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)=
③如果用食盐处理其只含银离子的废水,测得处理后的废水中NaCl的质量分数为0.117%,若环境要求排放标准为c(Ag+)低于1.0×10-18mol?L-1,则该工厂处理后的废水是否符合排放标准
查看习题详情和答案>>
(1)通过控制溶液的pH对工业废水中的金属离子进行分离是实际工作中经常使用的分离方法.下图是某些金属氢氧化物在不同浓度和pH下的沉淀-溶解图.图中直线上的点表示一种平衡状态.通常认为残留在溶液中的离子浓度小于1×10-5mol?L-1时,该离子沉淀完全.

(1)则由上图可得Fe(OH)2的溶度积的值为
1×10-15
1×10-15
.(2)上图中A、B、C三点中表示Fe(OH)3的沉淀速率大于溶解速率的是
C
C
点.(3)某工厂废水(pH=2.0,ρ=1.0g?mL-1)中含Ag+、Pb2+等 重金属离子,其浓度各约为0.01mol?L-1.排放前拟用沉淀法除去这两种离子,查找有关数据如下:
| 难溶电解质 | AgCl | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
| Ksp | 1.8×10-10 | 8.3×10-17 | 5.6×10-18 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
B
B
(填字母序号),沉淀效果最好.A.NaOH B.Na2S C.KI D.Ca(OH)2
②如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)=
1.2×10-3 mol?L-1
1.2×10-3 mol?L-1
.③如果用食盐处理其只含银离子的废水,测得处理后的废水中NaCl的质量分数为0.117%,若环境要求排放标准为c(Ag+)低于1.0×10-18mol?L-1,则该工厂处理后的废水是否符合排放标准
否
否
.(填“是”或“否”)为测定某生铁(假设仅含Fe和C)粉末状样品中铁的质量分数,某化学研究性学习小组设计有关方案进行如下实验.

(1)设计如图甲所示装置,生铁和稀硫酸分装在Y型玻璃管中,使生铁样品与稀硫酸反应的操作为
实验结束后,读出量气管中的气体体积(换算为标准状况),计算生铁样品中铁的质量分数,测定的结果偏低,可能的原因是
A.反应结束并冷却后,未再次调节量气管和水准管中液面相平,即读取气体体积.
B.稀硫酸过量
(2)设计如图乙所示装置,测得反应前后的有关质量如表,则生铁样品中铁的质量分数为
×100%
×100%,
根据图中装置判断,若实验中操作没有失误,该实验结果可能
确”).
(3)若取生铁粉末5.72g,在高温下的氧气流中充分反应,得到CO2气体224mL(标准状况).则此生铁粉末中铁和碳的物质的量之比为
查看习题详情和答案>>

(1)设计如图甲所示装置,生铁和稀硫酸分装在Y型玻璃管中,使生铁样品与稀硫酸反应的操作为
将Y型管倾斜,使硫酸溶液流入到生铁样品中
将Y型管倾斜,使硫酸溶液流入到生铁样品中
.实验结束后,读出量气管中的气体体积(换算为标准状况),计算生铁样品中铁的质量分数,测定的结果偏低,可能的原因是
A
A
(填字母序号).A.反应结束并冷却后,未再次调节量气管和水准管中液面相平,即读取气体体积.
B.稀硫酸过量
(2)设计如图乙所示装置,测得反应前后的有关质量如表,则生铁样品中铁的质量分数为
| 28(a+m-b) |
| m |
| 28(a+m-b) |
| m |
根据图中装置判断,若实验中操作没有失误,该实验结果可能
偏大
偏大
(填“偏大”、“偏小”或“准确”).
| 反应前:整套装置+稀硫酸质量/g | 反应前: 生铁样品质量/g |
反应后:整套装置+ 锥形瓶中剩余物的质量/g |
| a | m | b |
10:1
10:1
.日本核泄漏中最危险的是131I,它能引发甲状腺癌.但127I却是人体必需的.
(1)下列有关碘的描述中,正确的是
A. 126I、127I、128I、131I是四种相同的核素
B.已知131I的半衰期很短,所以浓度极低时不会对公众健康构成危害
C.127I可阻隔甲状腺吸收放射性131I.碘盐含127I为 30mg?kg-1,成人一次摄入碘盐约3kg才有预防效果.所以,日用碘盐对预防碘辐射起不到有效作用
D.碘片含127I 为100mg/片,一片能阻断90%放射性碘在甲状腺内沉积,按医嘱服用碘片可防止131I的辐射
(2)碘盐(含KIO3)含碘量可用下列方法来测定:IO3-+5I -+6H+=3I2+3H2O; I2+2S2O32-=2I -+S4O62-取a g碘盐于锥形瓶中,用适量水溶解,再加入过量的KI溶液并用硫酸酸化,用b mol?L-1 Na2S2O3溶液滴定I2,滴定终点时用去c mL Na2S2O3溶液,则该盐中碘的质量分数为
(用a、b、c表示).
(3)碘不易溶于水,但易溶于碘化钾溶液并生成含碘离子(aq表示水合状态)
I2(aq)+I -(aq)?I3-(aq) …①
I2(aq)+2I -(aq)?I 42-(aq) …②
则反应②的平衡常数表达式,K=
.
I2的起始浓度均为0.1mol?L-1,不同起始浓度KI溶液中,达到平衡时含碘离子的物质的量分数如下表:
根据表中数据,可得出的两条结论是
查看习题详情和答案>>
(1)下列有关碘的描述中,正确的是
BCD
BCD
.A. 126I、127I、128I、131I是四种相同的核素
B.已知131I的半衰期很短,所以浓度极低时不会对公众健康构成危害
C.127I可阻隔甲状腺吸收放射性131I.碘盐含127I为 30mg?kg-1,成人一次摄入碘盐约3kg才有预防效果.所以,日用碘盐对预防碘辐射起不到有效作用
D.碘片含127I 为100mg/片,一片能阻断90%放射性碘在甲状腺内沉积,按医嘱服用碘片可防止131I的辐射
(2)碘盐(含KIO3)含碘量可用下列方法来测定:IO3-+5I -+6H+=3I2+3H2O; I2+2S2O32-=2I -+S4O62-取a g碘盐于锥形瓶中,用适量水溶解,再加入过量的KI溶液并用硫酸酸化,用b mol?L-1 Na2S2O3溶液滴定I2,滴定终点时用去c mL Na2S2O3溶液,则该盐中碘的质量分数为
| 127bc×10-3 |
| 6a |
| 127bc×10-3 |
| 6a |
(3)碘不易溶于水,但易溶于碘化钾溶液并生成含碘离子(aq表示水合状态)
I2(aq)+I -(aq)?I3-(aq) …①
I2(aq)+2I -(aq)?I 42-(aq) …②
则反应②的平衡常数表达式,K=
c
| ||
| c(I2)?c2(I-) |
c
| ||
| c(I2)?c2(I-) |
I2的起始浓度均为0.1mol?L-1,不同起始浓度KI溶液中,达到平衡时含碘离子的物质的量分数如下表:
| KI起始浓度/mol?L-1 | 0.02 | 0.04 | 0.06 | 0.08 | 0.10 |
| I3-% | 88.98 | 88.04 | 85.28 | 82.26 | 79.23 |
| I42-% | 4.38 | 8.67 | 12.60 | 16.21 | 19.53 |
条件相同时,I3-离子的物质的量分数组成始终占绝对优势
条件相同时,I3-离子的物质的量分数组成始终占绝对优势
、随I-离子浓度的增加,I3-离子的物质的量分数降低,I42-离子的物质的量分数增加
随I-离子浓度的增加,I3-离子的物质的量分数降低,I42-离子的物质的量分数增加
.(2011?静安区模拟)某学习小组根据化学知识和右上表的数据,设计了下表中的实验,以验证酸性:盐酸>碳酸>苯酚>碳酸氢根离子.
|
查看习题详情和答案>>
联合国气候变化大会2009年12月7日在丹麦首都哥本哈根拉开帷幕,降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.
(1)工业上有一种方法是用CO2来生产燃料甲醇.298.15K时,CO2、H2、与CH3OH、H2O的平均能量与合成甲醇反应的活化能的曲线图如图所示,据图回答问题:

①写出合成甲醇反应的热化学方程式
②在图中曲线
③在体积为l L的密闭容器中,充入lmol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化如图所示.

从反应开始到平衡,甲醇的平均反应速率v(CH3OH)=
该反应的平衡常数k=
.
(2)乙醇是重要的化工产品和液体燃料,同样可以利用CO2反应制取乙醇:
2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011
CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011
在一定压强下,测得反应的实验数据如下表.分析表中数据回答下列问题:
 ①温度升高,K值
①温度升高,K值
②提高氢碳比[n(H2)/n(CO2)],K值
③在右图的坐标系中作图说明压强变化对反应①的化学平衡的影响.并对图中横坐标、纵坐标的含义作必要的标注.
查看习题详情和答案>>
(1)工业上有一种方法是用CO2来生产燃料甲醇.298.15K时,CO2、H2、与CH3OH、H2O的平均能量与合成甲醇反应的活化能的曲线图如图所示,据图回答问题:

①写出合成甲醇反应的热化学方程式
CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-(n-m)kJ?mol-1
CH3OH(g)+H2O(g)△H=-(n-m)kJ?mol-1
 CH3OH(g)+H2O(g)△H=-(n-m)kJ?mol-1
CH3OH(g)+H2O(g)△H=-(n-m)kJ?mol-1CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-(n-m)kJ?mol-1
CH3OH(g)+H2O(g)△H=-(n-m)kJ?mol-1
; CH3OH(g)+H2O(g)△H=-(n-m)kJ?mol-1
CH3OH(g)+H2O(g)△H=-(n-m)kJ?mol-1②在图中曲线
b
b
(填“a”或“b”)表示加入催化剂的能量变化曲线,催化剂能加快反应速率的原理是催化剂能降低该反应的活化能,提高活化分子的百分数,化学反应速率加快
催化剂能降低该反应的活化能,提高活化分子的百分数,化学反应速率加快
;③在体积为l L的密闭容器中,充入lmol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化如图所示.

从反应开始到平衡,甲醇的平均反应速率v(CH3OH)=
0.075mol?L-1?min-1
0.075mol?L-1?min-1
;该反应的平衡常数k=
| 16 |
| 3 |
| 16 |
| 3 |
(2)乙醇是重要的化工产品和液体燃料,同样可以利用CO2反应制取乙醇:
2CO2(g)+6H2(g)
 CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011
CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011在一定压强下,测得反应的实验数据如下表.分析表中数据回答下列问题:
 |
500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
 ①温度升高,K值
①温度升高,K值减小
减小
(填“增大”、“减小”、或“不变”).②提高氢碳比[n(H2)/n(CO2)],K值
不变
不变
(填“增大”、“减小”、或“不变”),对生成乙醇有利
有利
(填“有利”或“不利”).③在右图的坐标系中作图说明压强变化对反应①的化学平衡的影响.并对图中横坐标、纵坐标的含义作必要的标注.