题目内容
(2009?淮安二模)饮用水安全状况与人类健康有着密切关系.重金属离子对河流、海洋会造成严重污染.沉淀法是处理含重金属离子污水常用的方法.
(1)通过控制溶液的pH对工业废水中的金属离子进行分离是实际工作中经常使用的分离方法.下图是某些金属氢氧化物在不同浓度和pH下的沉淀-溶解图.图中直线上的点表示一种平衡状态.通常认为残留在溶液中的离子浓度小于1×10-5mol?L-1时,该离子沉淀完全.
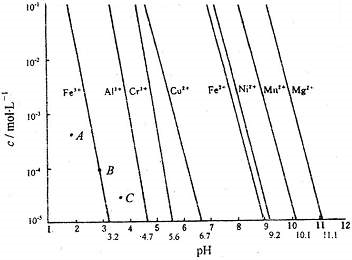
(1)则由上图可得Fe(OH)2的溶度积的值为
(2)上图中A、B、C三点中表示Fe(OH)3的沉淀速率大于溶解速率的是
(3)某工厂废水(pH=2.0,ρ=1.0g?mL-1)中含Ag+、Pb2+等 重金属离子,其浓度各约为0.01mol?L-1.排放前拟用沉淀法除去这两种离子,查找有关数据如下:
①你认为往废水中投入
A.NaOH B.Na2S C.KI D.Ca(OH)2
②如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)=
③如果用食盐处理其只含银离子的废水,测得处理后的废水中NaCl的质量分数为0.117%,若环境要求排放标准为c(Ag+)低于1.0×10-18mol?L-1,则该工厂处理后的废水是否符合排放标准
(1)通过控制溶液的pH对工业废水中的金属离子进行分离是实际工作中经常使用的分离方法.下图是某些金属氢氧化物在不同浓度和pH下的沉淀-溶解图.图中直线上的点表示一种平衡状态.通常认为残留在溶液中的离子浓度小于1×10-5mol?L-1时,该离子沉淀完全.

(1)则由上图可得Fe(OH)2的溶度积的值为
1×10-15
1×10-15
.(2)上图中A、B、C三点中表示Fe(OH)3的沉淀速率大于溶解速率的是
C
C
点.(3)某工厂废水(pH=2.0,ρ=1.0g?mL-1)中含Ag+、Pb2+等 重金属离子,其浓度各约为0.01mol?L-1.排放前拟用沉淀法除去这两种离子,查找有关数据如下:
| 难溶电解质 | AgCl | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
| Ksp | 1.8×10-10 | 8.3×10-17 | 5.6×10-18 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
B
B
(填字母序号),沉淀效果最好.A.NaOH B.Na2S C.KI D.Ca(OH)2
②如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)=
1.2×10-3 mol?L-1
1.2×10-3 mol?L-1
.③如果用食盐处理其只含银离子的废水,测得处理后的废水中NaCl的质量分数为0.117%,若环境要求排放标准为c(Ag+)低于1.0×10-18mol?L-1,则该工厂处理后的废水是否符合排放标准
否
否
.(填“是”或“否”)分析:(1)由图象可知,当PH=9时,c(Fe2+)=1×10-5mol?L-1,再根据Ksp表达式求算;
(2)曲线上的点为饱和溶液时,曲线左边是未饱和溶液,右边为过饱和溶液;
(3)①根据Ksp大小分析,Ksp越小,溶解度越小,沉淀越完全;
②根据Pb(OH)2的Ksp求算;
③由废水中NaCl的质量分数为0.117%,求出c(Cl-),再根据AgCl的Ksp求出c(Ag+).
(2)曲线上的点为饱和溶液时,曲线左边是未饱和溶液,右边为过饱和溶液;
(3)①根据Ksp大小分析,Ksp越小,溶解度越小,沉淀越完全;
②根据Pb(OH)2的Ksp求算;
③由废水中NaCl的质量分数为0.117%,求出c(Cl-),再根据AgCl的Ksp求出c(Ag+).
解答:解:(1)由图象可知,当PH=9时,c(Fe2+)=1×10-5mol?L-1,Ksp=c(Fe2+)?c2(OH-)=1×10-5×(1×10-5)2 =1×10-15,故答案为:1×10-15;
(2)曲线上的点为饱和溶液时,曲线左边是未饱和溶液,右边为过饱和溶液;在过饱和溶液中要有固体析出,C点为过饱和溶液,其溶质的沉淀速率大于溶解速率,
故答案为:C;
(3)①根据Ksp大小分析,Ksp越小,溶解度越小,沉淀越完全,由表中数据可知Ag2S和PbS的Ksp小,所以应该选用Na2S作沉淀剂,故答案为:B;
②根据Pb(OH)2的Ksp求算,;已知溶液的pH=8.0,则C(OH-)=10-6mol?L-1 Ksp=c(Pb2+)?c2(OH-),所以c(Pb2+)=1.2×10-3 mol?L-1,故答案为:1.2×10-3 mol?L-1
③设废水体积为1L,则废水的质量约为1000g,则m(NaCl)=1000×0.117%=1.17g,n(NaCl)=
=
=0.02mol,所以c(Cl-)=
=
=0.02mol/L,再根据AgCl的Ksp求出c(Ag+),则c(Ag+)=9×10-9mol/L,大于排放标准1.0×10-18mol?L-1,所以不符合排放标准,故答案为:否;
(2)曲线上的点为饱和溶液时,曲线左边是未饱和溶液,右边为过饱和溶液;在过饱和溶液中要有固体析出,C点为过饱和溶液,其溶质的沉淀速率大于溶解速率,
故答案为:C;
(3)①根据Ksp大小分析,Ksp越小,溶解度越小,沉淀越完全,由表中数据可知Ag2S和PbS的Ksp小,所以应该选用Na2S作沉淀剂,故答案为:B;
②根据Pb(OH)2的Ksp求算,;已知溶液的pH=8.0,则C(OH-)=10-6mol?L-1 Ksp=c(Pb2+)?c2(OH-),所以c(Pb2+)=1.2×10-3 mol?L-1,故答案为:1.2×10-3 mol?L-1
③设废水体积为1L,则废水的质量约为1000g,则m(NaCl)=1000×0.117%=1.17g,n(NaCl)=
| m |
| M |
| 1.17g |
| 58.5g/mol |
| n |
| V |
| 0.02mol |
| 1L |
点评:本题考查了溶液浓度的计算,Ksp的计算及应用,解决本题要注意分析图象和表格中的数据,题目难度适中.

练习册系列答案
相关题目
 (2009?淮安二模)锰酸锂离子蓄电池是第二代锂离子动力电池.它的问世使得锂离子动力电池在纯电动汽车与混合动力车等大型蓄电池应用领域占据主导地位.电池反应式为:Li1-xMnO4+LixC=LiMnO4+C,下列有关说法不正确的是( )
(2009?淮安二模)锰酸锂离子蓄电池是第二代锂离子动力电池.它的问世使得锂离子动力电池在纯电动汽车与混合动力车等大型蓄电池应用领域占据主导地位.电池反应式为:Li1-xMnO4+LixC=LiMnO4+C,下列有关说法不正确的是( )