题目内容
(2011?静安区模拟)某学习小组根据化学知识和右上表的数据,设计了下表中的实验,以验证酸性:盐酸>碳酸>苯酚>碳酸氢根离子.
|
分析:A、强酸置换弱酸的反应;
B、苯酚溶解度小,变浑浊,证明碳酸酸性大于苯酚的酸性;
C、越弱越水解,根据盐的水解进行判断;
D、碳酸钠对应的酸是碳酸,应该看是否生成气体.
B、苯酚溶解度小,变浑浊,证明碳酸酸性大于苯酚的酸性;
C、越弱越水解,根据盐的水解进行判断;
D、碳酸钠对应的酸是碳酸,应该看是否生成气体.
解答:解:A、往碳酸钙固体中滴加盐酸,有气体产生,证明了酸性碳酸大于苯酚,故A错误;
B、向苯酚钠饱和溶液中通入足量二氧化碳,生成苯酚和碳酸氢钠,可得到酸性碳酸>苯酚,故B错误;
C、配制同物质的量浓度的碳酸钠溶液和苯酚钠溶液,比较溶液的pH,比较出来只能是苯酚和碳酸氢根的酸性,因为碳酸是二元酸,若要通过此种方法比较苯酚和碳酸的酸性,应当配制等物质的量浓度的碳酸氢钠溶液和苯酚钠溶液,再比较其pH值.,故C正确;
D、在苯酚悬浊液中,加入过量的 Na2CO3溶液,溶液变澄清,苯酚和碳酸钠生成了苯酚钠和碳酸氢钠,不能证明碳酸酸性大于苯酚,应该看是否有气体产生,故D正确;
故选CD.
B、向苯酚钠饱和溶液中通入足量二氧化碳,生成苯酚和碳酸氢钠,可得到酸性碳酸>苯酚,故B错误;
C、配制同物质的量浓度的碳酸钠溶液和苯酚钠溶液,比较溶液的pH,比较出来只能是苯酚和碳酸氢根的酸性,因为碳酸是二元酸,若要通过此种方法比较苯酚和碳酸的酸性,应当配制等物质的量浓度的碳酸氢钠溶液和苯酚钠溶液,再比较其pH值.,故C正确;
D、在苯酚悬浊液中,加入过量的 Na2CO3溶液,溶液变澄清,苯酚和碳酸钠生成了苯酚钠和碳酸氢钠,不能证明碳酸酸性大于苯酚,应该看是否有气体产生,故D正确;
故选CD.
点评:本题考查了根据反应现象判断酸性强弱,注意方案的合理性和严密性,本题难度中等.

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
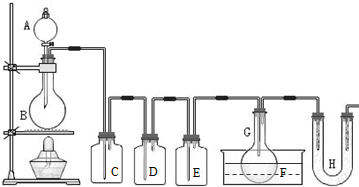 (2011?静安区模拟)用如图所示装置制取PCl3,在E中放入足量白磷,将氯气不间断地通入E,氯气与白磷就会发生反应,并放出热量(温度高于75℃).已知:PCl3和 PCl5遇水强烈反应,它们熔沸点数据如下:
(2011?静安区模拟)用如图所示装置制取PCl3,在E中放入足量白磷,将氯气不间断地通入E,氯气与白磷就会发生反应,并放出热量(温度高于75℃).已知:PCl3和 PCl5遇水强烈反应,它们熔沸点数据如下: