网址:http://m.1010jiajiao.com/timu3_id_36882[举报]

(1)该药品中Fe2+ 会缓慢氧化,国家规定该药物中Fe2+ 的氧化率超过10%即不能再服用.
1为了检验某药店出售的“速力菲”是否氧化,实验室可选用最常用最灵敏的检验试剂为
②实验室采用H2SO4酸化的KMnO4溶液,对“速力菲”中的Fe2+ 进行滴定(假设药品中,其它成分不与KMnO4反应).请配平下列离子方程式
③称量上述含铁元素质量分数为20.00% 的“速力菲”10.00g,将其全部溶于稀硫酸中,配制成1000.00mL溶液,取出20.00mL,用0.01mol/L的KMnO4溶液滴定,用去KMnO4溶液12.00mL.该药品可以服用吗?
(2)已知琥珀酸亚铁相对分子质量为172,琥珀酸为有机酸.含23.6g琥珀酸的溶液与4mol/L 100mL的氢氧化钠溶液恰好完全中和.质子核磁共振分析显示,琥珀酸分子中只含有两种位置不同的氢原子.写出琥珀酸溶液与氢氧化钠溶液完全中和的离子方程式(有机物须写结构简式)
(1)将Fe(OH)3与NaClO溶液混合,可制得Na2FeO4,完成并配平下列离子方程式
(2)某地海水样品经Na2FeO4处理后,所含离子及其浓度如下表所示(H+和0H-未列出):
| 离子 | SO42- | Mg2+ | Fe3+ | Na+ | Cl- |
| 浓度(mol/L) | a | 0.05 | 0.10 | 0.50 | 0.58 |
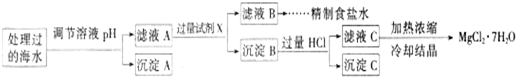
注:离子的浓度小于1.0×10-5mol/L,可认为该离子不存在;Ksp[Fe(OH)3]=1.0×10-38 Ksp[Mg(OH)2]=5.0×10-12;操作过程中溶液体积变化忽略不计.
①表格中的a
②沉淀A的组成为
③加入的过量试剂X为
④加入过量HCl的作用为
下列离子方程式正确的是 ( )
| A.高锰酸钾与浓盐酸反应:2 MnO4- + 10 Cl- + 16 H+ =" 2" Mn2+ + 5 Cl2↑ + 8 H2O |
| B.标准状况112 mLCl2通入10 mL 1mol/LFeBr2溶液:2Fe2++4Br-+3Cl2=2Fe3++6Cl-+2Br2 |
C.浓盐酸和KClO3反应: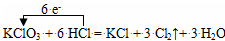 |
| D.硫化钠溶于水显碱性:S2- + 2H2O = H2S + 2OH- |
 |
工业上制取CuCl2的生产流程如下:
请结合下表数据,回答问题:
| 物 质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
|
| 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
(1)写出下列离子方程式:
A→B ; B→C+D 。
(2)溶液A中加入NaClO的目的是 。
(3)在溶液B中加入CuO的作用是 。
(4)操作①应控制的pH范围是: ;操作②的目的是 。
(5)由Cu(OH)2加入盐酸使Cu(OH)2转变为CuCl2。采用“稍多量盐酸”和“低温蒸干”的目的是 。
查看习题详情和答案>>为了测定含有H2C2O4·2H2O、KHC2O4和K2SO4的试样中各物质的质量分数,进行如下实验:
①称取6.0 g试样,加水溶解,配成250 mL试样溶液。
②用酸式滴定管量取25.00 mL试样溶液放入锥形瓶中,并加入2~3滴酚酞试液,用0.2500 mol/L NaOH溶液滴定,消耗NaOH溶液20.00 mL。
③再取25.00 mL试样溶液放入另一锥形瓶中,用0.1000 mol/L的酸性高锰酸钾溶液滴定,消耗高锰酸钾溶液16.00 mL。
回答下列问题:
(1)已知:0.10 mol/L KHC2O4溶液pH约为3,其中含碳元素的粒子浓度由大到小的顺序为 。
(2)步骤①所需要的玻璃仪器有烧杯、玻璃棒、 。
(3)完成并配平下列离子方程式: C2O42-+ MnO4-+ H+= CO2+ Mn2++
(4)滴定时边滴边摇动锥形瓶,眼睛应观察 。
(5)步骤②中量取试样溶液时,酸式滴定管用蒸馏水洗过后没有润洗,则测得的H2C2O4·2H2O的质量分数 。(填“偏大”、“偏小”或“无影响”)
(6)步骤③中判断滴定终点的方法是 。
(7)试样中H2C2O4·2H2O的质量分数为 。
查看习题详情和答案>>