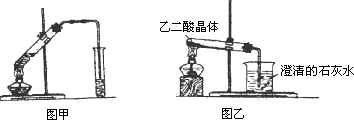
题目内容
为了测定含有H2C2O4·2H2O、KHC2O4和K2SO4的试样中各物质的质量分数,进行如下实验:
①称取6.0 g试样,加水溶解,配成250 mL试样溶液。
②用酸式滴定管量取25.00 mL试样溶液放入锥形瓶中,并加入2~3滴酚酞试液,用0.2500 mol/L NaOH溶液滴定,消耗NaOH溶液20.00 mL。
③再取25.00 mL试样溶液放入另一锥形瓶中,用0.1000 mol/L的酸性高锰酸钾溶液滴定,消耗高锰酸钾溶液16.00 mL。
回答下列问题:
(1)已知:0.10 mol/L KHC2O4溶液pH约为3,其中含碳元素的粒子浓度由大到小的顺序为 。
(2)步骤①所需要的玻璃仪器有烧杯、玻璃棒、 。
(3)完成并配平下列离子方程式: C2O42-+ MnO4-+ H+= CO2+ Mn2++
(4)滴定时边滴边摇动锥形瓶,眼睛应观察 。
(5)步骤②中量取试样溶液时,酸式滴定管用蒸馏水洗过后没有润洗,则测得的H2C2O4·2H2O的质量分数 。(填“偏大”、“偏小”或“无影响”)
(6)步骤③中判断滴定终点的方法是 。
(7)试样中H2C2O4·2H2O的质量分数为 。
(12分) (1) c(HC2O4-)>c(C2O42-)>c(H2C2O4) (2分)
(2)胶头滴管、250 mL容量瓶(2分)、(量筒)
(3) 5,2,16 10,2,8H2O(2分) (4) 锥形瓶中溶液颜色变化(1分)
(5) 偏小(1分) (6) 溶液由无色变成浅紫红色,且半分钟内不褪色(1分) (7) 21%(3分)
【解析】
试题分析:(1)已知0.10 mol/L KHC2O4溶液pH约为3,溶液显酸性,这说明HC2O4-的电离程度大于HC2O4-的水解程度。由于不论是水解,还是电离,程度都是很小的,所以溶液中含碳元素的粒子浓度由大到小的顺序为c(HC2O4-)>c(C2O42-)>c(H2C2O4)。
(2)实验室配成250 mL试样溶液需要的仪器主要有烧杯、玻璃棒、胶头滴管和250ml容量瓶。
(3)根据反应式可知,C2O42-中碳元素的化合价从+3价升高到+4价,失去1个电子。MnO4-中Mn元素的化合价从+7价降低到+2价,得到5个电子,所以根据电子得失守恒可知,还原剂C2O42-与氧化剂MnO4-的物质的量之比是5:2,然后根据原子守恒可知,反应中还有水生成,所以配平后的离子方程式为5C2O42-+2MnO4-+16H+=10CO2+2Mn2++8H2O。
(4)滴定实验中准确判断终点是实验的关键,所以滴定时边滴边摇动锥形瓶,眼睛应观察锥形瓶中溶液颜色变化。
(5)步骤②中量取试样溶液时,酸式滴定管用蒸馏水洗过后没有润洗,则导致溶液额浓度被稀释,所以消耗氢氧化钠溶液的体积减少,所以测得的H2C2O4·2H2O的质量分数偏小。
(6)由于酸性高锰酸钾溶液在溶液中显紫红色,所以步骤③中判断滴定终点的方法是溶液由无色变成浅紫红色,且半分钟内不褪色。
(7)设H2C2O4·2H2O、KHC2O4的物质的量分别是x 和y。25ml溶液消耗氢氧化钠的物质的量=0.02000L×0.2500 mol/L=0.005000mol,则250ml溶液消耗氢氧化钠的物质的量=0.005000mol×10=0.05000mol,则2x+y=0.05000mol。25ml溶液消耗高锰酸钾的物质的量=0.1000 mol/L×0.01600L=0.001600mol,所以250ml溶液消耗高锰酸钾的物质的量=0.001600mol×10=0.01600mol,则根据电子得失守恒可知,2x+2y=0.01600mol×5=0.08000mol,解得x=0.01000mol、y=0.03000mol,所以试样中H2C2O4·2H2O的质量分数为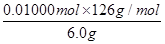 ×100%=21%。
×100%=21%。
考点:考查溶液中离子浓度大小比较;一定物质的量浓度配制;滴定实验判断和误差分析;氧化还原反应方程式的配平;物质含量的测定和计算


 HCO3-+OH-
HCO3-+OH-