摘要:74.洋务派主张的“中学为体.西学为用 的含义是 ①不改变中国固有的制度和纲常礼教 ②只有采用西方近代科学技术才能“自强 “求富 ③学习西方先进的政治制度来维护清王朝的统治 ④用西方资产阶级的思想学说来挽救清政府 A.①② B.②③ C.③④ D.①④
网址:http://m.1010jiajiao.com/timu3_id_36400[举报]
(12分)固体A是离子晶体,结构类似于CsCl,组成中含氮的质量分数为73.68%,它的所有原子的最外层都符合相应的稀有气体原子的最外层电子结构。该物质适当加热就分解成两种气体单质。试回答下列问题:
1.写出A的化学式 ,A的电子式 ;阳离子的结构为 体,其中心原子的杂化形态为 。
2.A溶于水后溶液呈 性(填“酸”、“碱”或“中”),其原因是(用化学方程式表示) 。
3.A与CuI在一定条件下可合成一种化合物B。B是一种红棕色、难溶于水的固体,X一射线衍射证实B是一种六方晶体,结构类同于闪锌矿(ZnS)测后的化学式为_________;生成B的化学反应为 。将B投入酸性溶液中(如盐酸溶液)可能看到的现象为 ,其化学反应方程式为 。
4.写出A受热分解的化学反应方程式 。该反应 (填“是”或“否”)属于氧化还原反应。
查看习题详情和答案>>[选做题](1)人们对酸碱的认识,已有几百年的历史,经历了一个由浅入深、由低级到高级的认识过程.目前中学课本中的酸碱理论是1889年阿仑尼乌斯(Arrhenius)提出的电离理论.
①1905年富兰克林(FranKlin)深入研究了水和液氨的相似性,把阿仑尼乌斯以水为溶剂的个别现象,推广到任何溶剂,提出了酸碱溶剂理论.溶剂理论认为:凡能电离而产生溶剂正离子的物质为酸,凡能电离而产生溶剂负离子的物质为碱.试写出液氨自身电离的方程式:
②1923年丹麦化学家布朗斯特(Bronsted)和英国化学家劳莱(Lowey)提出质子理论.凡是能够释放质子(氢离子)任何含氢原子的分子或离子都是酸;凡是能够与质子(氢离子)结合的分子或离子都是碱.
按质子理论:下列粒子在水溶液既可以看作酸又可看碱的是
A、H2O B、NH4+ C、OH- D、HCO3- E、CH3COO- F、Cl-
③1923年路易斯(Lewis)提出广义的酸碱概念.凡是能给出电子对而形成化学键的物质都是碱;凡是能够和电子对结合的物质都是酸.
酸(电子对接受体)+碱(电子对给予体)→反应产物,如:H++OH-→H2O.
试指出下列两个反应中的酸或碱:
(Ⅰ)H3BO3+H2O H++B(OH)4-,该反应中的碱是
H++B(OH)4-,该反应中的碱是
(Ⅱ)NaH+H2O═NaOH+H2↑,该反应中的酸是
(2)已知A元素原子的K、L层电子数之和比M、L层电子数之和多一个电子;B元素原子核外电子占有9个轨道,且有1个未成对电子;C元素原子核外3p亚层中3个轨道还需5个电子才能达到全充满.D元素只有两个电子层,且最高化合价与最低化合价的代数和为零;E原子半径最小;F元素最外层电子排布为nSnnPn+1.按要求填写
①B的电子排布式是:
②D元素单质的晶体类型是
③E和F形成的化合物空间构型为
查看习题详情和答案>>
①1905年富兰克林(FranKlin)深入研究了水和液氨的相似性,把阿仑尼乌斯以水为溶剂的个别现象,推广到任何溶剂,提出了酸碱溶剂理论.溶剂理论认为:凡能电离而产生溶剂正离子的物质为酸,凡能电离而产生溶剂负离子的物质为碱.试写出液氨自身电离的方程式:
2NH3=NH4++NH2-
2NH3=NH4++NH2-
.②1923年丹麦化学家布朗斯特(Bronsted)和英国化学家劳莱(Lowey)提出质子理论.凡是能够释放质子(氢离子)任何含氢原子的分子或离子都是酸;凡是能够与质子(氢离子)结合的分子或离子都是碱.
按质子理论:下列粒子在水溶液既可以看作酸又可看碱的是
AD
AD
.A、H2O B、NH4+ C、OH- D、HCO3- E、CH3COO- F、Cl-
③1923年路易斯(Lewis)提出广义的酸碱概念.凡是能给出电子对而形成化学键的物质都是碱;凡是能够和电子对结合的物质都是酸.
酸(电子对接受体)+碱(电子对给予体)→反应产物,如:H++OH-→H2O.
试指出下列两个反应中的酸或碱:
(Ⅰ)H3BO3+H2O
 H++B(OH)4-,该反应中的碱是
H++B(OH)4-,该反应中的碱是H2O
H2O
(填H3BO3或H2O);(Ⅱ)NaH+H2O═NaOH+H2↑,该反应中的酸是
H2O
H2O
(填NaH 或H2O).(2)已知A元素原子的K、L层电子数之和比M、L层电子数之和多一个电子;B元素原子核外电子占有9个轨道,且有1个未成对电子;C元素原子核外3p亚层中3个轨道还需5个电子才能达到全充满.D元素只有两个电子层,且最高化合价与最低化合价的代数和为零;E原子半径最小;F元素最外层电子排布为nSnnPn+1.按要求填写
①B的电子排布式是:
1s22s22p63s23p5
1s22s22p63s23p5
,A、B两元素形成的化合物的晶体类型是离子晶体
离子晶体
.②D元素单质的晶体类型是
原子晶体
原子晶体
,C单质的制备方法是:电解法
电解法
.③E和F形成的化合物空间构型为
三角锥型
三角锥型
,该物质比D与E形成的化合物更容易液化的原因是E和F形成的化合物分子间能形成氢键
E和F形成的化合物分子间能形成氢键
.(1)A、B、C、D为四种晶体,性质如下:
A.固态时能导电,能溶于盐酸
B.能溶于CS2,不溶于水
C.固态时不导电,液态时能导电,可溶于水
D.固态、液态时均不导电,熔点为3 500℃
试推断它们的晶体类型:
A.
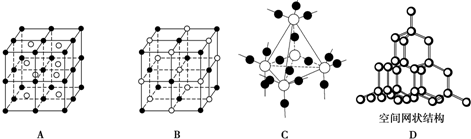
(2)下图中A~D是中学化学教科书上常见的几种晶体结构模型,请填写相应物质的名称:
A.
(3)下列六种晶体:①H2O,②NaCl,③Na,④Si,⑤H2S,⑥金刚石,它们的熔点从低到高的顺序为
(4)如图是金属钨晶体中的一个晶胞的结构示意图,它是一种体心立方结构.实验测得金属钨的密度为ρ g?cm-3,钨的相对原子质量是M.假设金属钨原子为等径刚性球,试完成下列问题: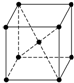
①每一个晶胞中分摊到
②晶胞的边长为
cm.
③钨的原子半径为
?
?
cm.
查看习题详情和答案>>
A.固态时能导电,能溶于盐酸
B.能溶于CS2,不溶于水
C.固态时不导电,液态时能导电,可溶于水
D.固态、液态时均不导电,熔点为3 500℃
试推断它们的晶体类型:
A.
金属晶体
金属晶体
;B.分子晶体
分子晶体
;C.离子晶体
离子晶体
;D.原子晶体
原子晶体
.(2)下图中A~D是中学化学教科书上常见的几种晶体结构模型,请填写相应物质的名称:
A.
氯化铯
氯化铯
;B.氯化钠
氯化钠
;C.二氧化硅
二氧化硅
;D.金刚石
金刚石
.
(3)下列六种晶体:①H2O,②NaCl,③Na,④Si,⑤H2S,⑥金刚石,它们的熔点从低到高的顺序为
⑤<①<③<②<④<⑥
⑤<①<③<②<④<⑥
(填序号).(4)如图是金属钨晶体中的一个晶胞的结构示意图,它是一种体心立方结构.实验测得金属钨的密度为ρ g?cm-3,钨的相对原子质量是M.假设金属钨原子为等径刚性球,试完成下列问题:

①每一个晶胞中分摊到
2
2
个钨原子.②晶胞的边长为
| 3 |
| ||
| 3 |
| ||
③钨的原子半径为
| ||
| 4 |
| 3 |
| ||
| ||
| 4 |
| 3 |
| ||
有机物A能发生如图所示的转化,所有化学反应都是中学化学常见的反应,部分产物未标出.
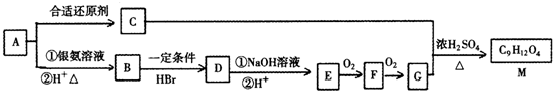
(1)写出下列反应的反应类型G+C→M反应类型 ;B→D反应类型 .
(2)A中含有的官能团的名称为 .
(3)若由C获得B,某同学设计了如下途径,最合理的是 .
A.加入酸性高锰酸钾氧化C
B.先加入H2加成,再加入酸性高锰酸钾氧化
C.先加入HCl加成,再加入酸性高锰酸钾氧化,然后加入NaOH溶液反应,并加酸酸化
D.先加入HBr加成,再加入酸性高锰酸钾氧化,然后加入NaOH醇溶液反应,并加酸酸化
(4)写出由M→G+C酸性条件下转化的化学反应方程式: .
(5)某芳香族化合物X与E具有相同类型和数目的官能团,且相对分子质量X比E大76.同时苯环上有两个对位取代基,则X的同分异构体有 种.
查看习题详情和答案>>

(1)写出下列反应的反应类型G+C→M反应类型
(2)A中含有的官能团的名称为
(3)若由C获得B,某同学设计了如下途径,最合理的是
A.加入酸性高锰酸钾氧化C
B.先加入H2加成,再加入酸性高锰酸钾氧化
C.先加入HCl加成,再加入酸性高锰酸钾氧化,然后加入NaOH溶液反应,并加酸酸化
D.先加入HBr加成,再加入酸性高锰酸钾氧化,然后加入NaOH醇溶液反应,并加酸酸化
(4)写出由M→G+C酸性条件下转化的化学反应方程式:
(5)某芳香族化合物X与E具有相同类型和数目的官能团,且相对分子质量X比E大76.同时苯环上有两个对位取代基,则X的同分异构体有
(1)玻璃棒是中学化学实验中常用的仪器.下列实验过程中,一般不需要用玻璃棒的是
①精盐提纯
②配制一定物质的量浓度的氯化钠溶液
③将适量氯化铁饱和溶液滴入沸水中制备氢氧化铁胶体
④探究Ba(OH)2?8H2O晶体和NH4Cl晶体反应过程中的能量变化
⑤实验室用新制的FeSO4溶液和预处理过的NaOH溶液制备Fe(OH)2白色沉淀
(2)填空:
①读取滴定管中滴体体积时,仰视液面,读取的体积数
②用托盘天平称取10.4g食盐,将砝码和食盐的位置颠倒,所称取食盐的质量为
③实验需用480mL 0.1mol?L-1NaOH溶液,配制溶液时除需用胶头滴管、烧杯、托盘天平(带砝码)、玻璃棒、药匙外,还必需用到的仪器是
查看习题详情和答案>>
③⑤
③⑤
(填写编号)①精盐提纯
②配制一定物质的量浓度的氯化钠溶液
③将适量氯化铁饱和溶液滴入沸水中制备氢氧化铁胶体
④探究Ba(OH)2?8H2O晶体和NH4Cl晶体反应过程中的能量变化
⑤实验室用新制的FeSO4溶液和预处理过的NaOH溶液制备Fe(OH)2白色沉淀
(2)填空:
①读取滴定管中滴体体积时,仰视液面,读取的体积数
>
>
实际体积数(填“>”、“=”或“<”)②用托盘天平称取10.4g食盐,将砝码和食盐的位置颠倒,所称取食盐的质量为
9.6
9.6
g.③实验需用480mL 0.1mol?L-1NaOH溶液,配制溶液时除需用胶头滴管、烧杯、托盘天平(带砝码)、玻璃棒、药匙外,还必需用到的仪器是
500mL容量瓶
500mL容量瓶
(填名称),所称取NaOH固体的质量为2.0
2.0
g.