题目内容
(1)A、B、C、D为四种晶体,性质如下:
A.固态时能导电,能溶于盐酸
B.能溶于CS2,不溶于水
C.固态时不导电,液态时能导电,可溶于水
D.固态、液态时均不导电,熔点为3 500℃
试推断它们的晶体类型:
A.
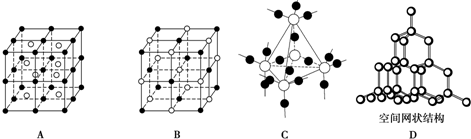
(2)下图中A~D是中学化学教科书上常见的几种晶体结构模型,请填写相应物质的名称:
A.
(3)下列六种晶体:①H2O,②NaCl,③Na,④Si,⑤H2S,⑥金刚石,它们的熔点从低到高的顺序为
(4)如图是金属钨晶体中的一个晶胞的结构示意图,它是一种体心立方结构.实验测得金属钨的密度为ρ g?cm-3,钨的相对原子质量是M.假设金属钨原子为等径刚性球,试完成下列问题: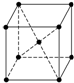
①每一个晶胞中分摊到
②晶胞的边长为
cm.
③钨的原子半径为
?
?
cm.
A.固态时能导电,能溶于盐酸
B.能溶于CS2,不溶于水
C.固态时不导电,液态时能导电,可溶于水
D.固态、液态时均不导电,熔点为3 500℃
试推断它们的晶体类型:
A.
金属晶体
金属晶体
;B.分子晶体
分子晶体
;C.离子晶体
离子晶体
;D.原子晶体
原子晶体
.(2)下图中A~D是中学化学教科书上常见的几种晶体结构模型,请填写相应物质的名称:
A.
氯化铯
氯化铯
;B.氯化钠
氯化钠
;C.二氧化硅
二氧化硅
;D.金刚石
金刚石
.
(3)下列六种晶体:①H2O,②NaCl,③Na,④Si,⑤H2S,⑥金刚石,它们的熔点从低到高的顺序为
⑤<①<③<②<④<⑥
⑤<①<③<②<④<⑥
(填序号).(4)如图是金属钨晶体中的一个晶胞的结构示意图,它是一种体心立方结构.实验测得金属钨的密度为ρ g?cm-3,钨的相对原子质量是M.假设金属钨原子为等径刚性球,试完成下列问题:

①每一个晶胞中分摊到
2
2
个钨原子.②晶胞的边长为
| 3 |
| ||
| 3 |
| ||
③钨的原子半径为
| ||
| 4 |
| 3 |
| ||
| ||
| 4 |
| 3 |
| ||
分析:(1)A.固态时能导电,能溶于盐酸,应为活泼金属;
B.能溶于CS2,不溶于水,应为分子晶体;
C.固态时不导电,液态时能导电,可溶于水,为离子晶体;
D.固态、液态时均不导电,熔点为3500℃,为原子晶体;
(2)根据晶体结构模型判断物质的种类;
(3)首先判断晶体的类型,一般来说晶体的熔沸点:原子晶体>离子晶体>金属晶体>分子晶体,晶体类型相同时要考虑影响晶体的因素;
(4)利用均摊法计算晶胞化学式,根据ρ=
计算.
B.能溶于CS2,不溶于水,应为分子晶体;
C.固态时不导电,液态时能导电,可溶于水,为离子晶体;
D.固态、液态时均不导电,熔点为3500℃,为原子晶体;
(2)根据晶体结构模型判断物质的种类;
(3)首先判断晶体的类型,一般来说晶体的熔沸点:原子晶体>离子晶体>金属晶体>分子晶体,晶体类型相同时要考虑影响晶体的因素;
(4)利用均摊法计算晶胞化学式,根据ρ=
| m |
| V |
解答:解:(1)A.固态时能导电,能溶于盐酸,应为活泼金属,为金属晶体;
B.能溶于CS2,不溶于水,应为分子晶体;
C.固态时不导电,液态时能导电,可溶于水,为离子晶体,分子晶体液态不导电;
D.固态、液态时均不导电,熔点为3500℃,为原子晶体;
故答案为:金属晶体;分子晶体;离子晶体;原子晶体;
(2)由晶胞结构模型可知A、B、C、D分别为氯化铯、氯化钠、二氧化硅、金刚石,
故答案为:氯化铯;氯化钠;二氧化硅;金刚石;
(3)①H2O,②NaCl,③Na,④Si,⑤H2S,⑥金刚石中,④⑥为原子晶体,由于原子半径④>⑥则,熔点⑥>④,②为离子晶体,③为金属晶体,①⑤都为分子晶体,但①含有氢键,熔沸点①>⑤,一般来说晶体的熔沸点:原子晶体>离子晶体>金属晶体>分子晶体,则它们的熔点从低到高的顺序为⑤<①<③<②<④<⑥,
故答案为:⑤<①<③<②<④<⑥;
(4)故答案为:①晶胞中钨位于晶胞的顶点和体心,晶胞平均含有8×
+1=2个钨原子,故答案为:2;
②设晶胞的边长为x,已知金属钨的密度为ρ g?cm-3,钨的相对原子质量是M,则晶胞的体积为x3cm3,
晶胞的质量为
,则有ρ=
,x=
cm,故答案为:
;
③因边长为
cm,设半径为r,原子紧密相邻,则r=
?
cm,故答案为:
?
.
B.能溶于CS2,不溶于水,应为分子晶体;
C.固态时不导电,液态时能导电,可溶于水,为离子晶体,分子晶体液态不导电;
D.固态、液态时均不导电,熔点为3500℃,为原子晶体;
故答案为:金属晶体;分子晶体;离子晶体;原子晶体;
(2)由晶胞结构模型可知A、B、C、D分别为氯化铯、氯化钠、二氧化硅、金刚石,
故答案为:氯化铯;氯化钠;二氧化硅;金刚石;
(3)①H2O,②NaCl,③Na,④Si,⑤H2S,⑥金刚石中,④⑥为原子晶体,由于原子半径④>⑥则,熔点⑥>④,②为离子晶体,③为金属晶体,①⑤都为分子晶体,但①含有氢键,熔沸点①>⑤,一般来说晶体的熔沸点:原子晶体>离子晶体>金属晶体>分子晶体,则它们的熔点从低到高的顺序为⑤<①<③<②<④<⑥,
故答案为:⑤<①<③<②<④<⑥;
(4)故答案为:①晶胞中钨位于晶胞的顶点和体心,晶胞平均含有8×
| 1 |
| 8 |
②设晶胞的边长为x,已知金属钨的密度为ρ g?cm-3,钨的相对原子质量是M,则晶胞的体积为x3cm3,
晶胞的质量为
| 2M |
| NA |
| ||
| x3 |
| 3 |
| ||
| 3 |
| ||
③因边长为
| 3 |
| ||
| ||
| 4 |
| 3 |
| ||
| ||
| 4 |
| 3 |
| ||
点评:该题是高考中的常见题型,属于中等难度的试题.试题贴近高考,综合性强,注重基础,侧重考查学生分析问题、解决问题的能力.也有了培养学生的逻辑思维能力和抽象思维能力,也有助于调动学生的学习兴趣和学习积极性,提高学生的学习效率.

练习册系列答案
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
相关题目
 已知:2NO2(g)?N2O4(g)△H<O.在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.
已知:2NO2(g)?N2O4(g)△H<O.在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示. 已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F.其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体类型在同周期的单质中没有相同的;F原子核外最外层电子数与B相同,其余各层电子均充满.请根据以上信息,回答下列问题:(答题时,A、B、C、D、E、F用所对应的元素符号表示)
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F.其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体类型在同周期的单质中没有相同的;F原子核外最外层电子数与B相同,其余各层电子均充满.请根据以上信息,回答下列问题:(答题时,A、B、C、D、E、F用所对应的元素符号表示)