摘要: (1) m = 4 (2) 16m (3) 3
网址:http://m.1010jiajiao.com/timu3_id_358712[举报]
(1)已知某反应的各物质浓度数据如下:aA(g)+bB(g) 2C(g)
2C(g)
起始浓度(mol/L):1.5 1.0 0
2s末浓度(mol/L):0.9 0.8 0.4
则①a=
②2S内B的反应速率=
(2)由碳棒,铁片和200mL 1.5mol/L的稀硫酸组成的原电
③有
④此时溶液中H+的物质的量浓度为
(3)将2.3g金属钠放入足量的m g重水(D2O)中,完全反应后,所得溶液中溶质的质量分数是
×100%
×100%(用含m的代数式表示)
查看习题详情和答案>>
 2C(g)
2C(g)起始浓度(mol/L):1.5 1.0 0
2s末浓度(mol/L):0.9 0.8 0.4
则①a=
3
3
,b1
1
.②2S内B的反应速率=
0.1mol/(L?S)
0.1mol/(L?S)
.(2)由碳棒,铁片和200mL 1.5mol/L的稀硫酸组成的原电
不要此空
不要此空
池中,当在碳棒上产生气体3.36L(标准状况)时,求③有
1.806×1023
1.806×1023
个电子通过了电线?(NA=6.02×1023)④此时溶液中H+的物质的量浓度为
1.5mol/L
1.5mol/L
(不考虑溶液体积变化).(3)将2.3g金属钠放入足量的m g重水(D2O)中,完全反应后,所得溶液中溶质的质量分数是
| 4.1 |
| 2.1+m |
| 4.1 |
| 2.1+m |
短周期元素X、Y、Z在元素周期表中的相对位置如下图所示.25℃,0.1mol?L-1 M溶液(M为Y的最高价氧化物所对应的水化物)的pH为13.
(1)Y的离子结构示意图为 .
(2)X、Z的气态氢化物稳定性较强的是 (填化学式).
(3)不能用带磨口玻璃塞的试剂瓶盛装M溶液的原因是 (用离子方程式表示).
(4)将X的最高价氧化物通入足量的M溶液中生成盐,该盐所含的化学键类型有 .
(5)工业上,用X单质制取Z单质的化学方程式为 .
(6)X的最高价氧化物与某一元有机酸的钾盐(化学式为KA,A-为酸根)溶液反应的化学方程式为 (已知25℃,X的最高价氧化物的水化物的电离常数为Ka1=4.2×10-7,Ka2=5.6×10-11,HA的电离常数Ka=1.1×10-10).
查看习题详情和答案>>
| X | |||
| Y | Z |
(2)X、Z的气态氢化物稳定性较强的是
(3)不能用带磨口玻璃塞的试剂瓶盛装M溶液的原因是
(4)将X的最高价氧化物通入足量的M溶液中生成盐,该盐所含的化学键类型有
(5)工业上,用X单质制取Z单质的化学方程式为
(6)X的最高价氧化物与某一元有机酸的钾盐(化学式为KA,A-为酸根)溶液反应的化学方程式为
草酸三氢钾是一种无色晶体或白色粉末,加热至100℃失水成无水物,更高温度时分解为碳酸钾和一氧化碳等,溶于水,微溶于醇.实验室有一KH3(C2O4)2?2H2O样品(混有一定量的H2C2O4和K2SO4).现欲测定其纯度,请回答下列问题:
(1)完成并配平离子反应方程式:
(2)请完成相应的实验步骤:
步骤1:称取35.60g草酸三氢钾试样,加水溶解,配成250mL溶液.
步骤2:用移液管量取两份此溶液各25.00mL,分别置于两个锥形瓶中.
步骤3:第1份溶液加硫酸酸化后,用0.1000mol?L-1的高锰酸钾溶液滴定,至滴定终点消耗高锰酸钾溶液12.00mL.
步骤4:在第2份溶液中
(3)根据(2)中的实验步骤回答:
①步骤1用到的实验仪器有:电子天平、药匙、烧杯、玻璃棒、
②如何判断步骤3中的滴定终点?
③3.560g试样中含有还原剂(草酸根)的物质的量共为
(4)热重分析法(TG)是在程序控制温度下,测量物质的质量与温度的关系的一种实验技术.热重分析仪的基本构造由精密天平、程序控温加热炉和记录仪组成;记录仪画出剩余固体质量(m)~炉温(T)曲线,即热重(TG)曲线图.如图为CaC2O4?H2O在N2和O2气氛中的热重曲线.
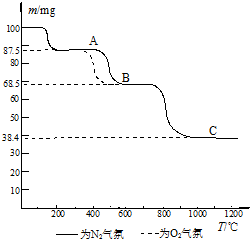
①C点所得固体的化学式为
②CaC2O4?H2O的分解分三个阶段,由图可看出,第二阶段在O2气氛中的反应速率要比在N2气氛中的快,原因是
查看习题详情和答案>>
(1)完成并配平离子反应方程式:
5
5
C2O42-+2
2
MnO4-+6
6
H+=10
10
CO2↑
CO2↑
+2
2
Mn2++8
8
H2O(2)请完成相应的实验步骤:
步骤1:称取35.60g草酸三氢钾试样,加水溶解,配成250mL溶液.
步骤2:用移液管量取两份此溶液各25.00mL,分别置于两个锥形瓶中.
步骤3:第1份溶液加硫酸酸化后,用0.1000mol?L-1的高锰酸钾溶液滴定,至滴定终点消耗高锰酸钾溶液12.00mL.
步骤4:在第2份溶液中
滴加酚酞试液
滴加酚酞试液
,用0.2500mol?L-1NaOH溶液滴定,至滴定终点消耗NaOH溶液20mL.(3)根据(2)中的实验步骤回答:
①步骤1用到的实验仪器有:电子天平、药匙、烧杯、玻璃棒、
250mL容量瓶
250mL容量瓶
、胶头滴管
胶头滴管
等.②如何判断步骤3中的滴定终点?
KMnO4最后一滴滴入溶液,溶液恰好变紫红色,且30s内不退色,此时便是滴定终点
KMnO4最后一滴滴入溶液,溶液恰好变紫红色,且30s内不退色,此时便是滴定终点
.③3.560g试样中含有还原剂(草酸根)的物质的量共为
0.3mol
0.3mol
.样品纯度为98.1%
98.1%
.(4)热重分析法(TG)是在程序控制温度下,测量物质的质量与温度的关系的一种实验技术.热重分析仪的基本构造由精密天平、程序控温加热炉和记录仪组成;记录仪画出剩余固体质量(m)~炉温(T)曲线,即热重(TG)曲线图.如图为CaC2O4?H2O在N2和O2气氛中的热重曲线.

①C点所得固体的化学式为
CaO
CaO
.②CaC2O4?H2O的分解分三个阶段,由图可看出,第二阶段在O2气氛中的反应速率要比在N2气氛中的快,原因是
氧气存在时第2步反应产生二氧化碳会抑制碳酸钙分解反应的进行
氧气存在时第2步反应产生二氧化碳会抑制碳酸钙分解反应的进行
(结合化学方程式回答).如表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题: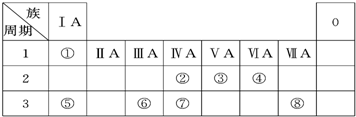
(1)写出由④、⑤、⑧元素中形成的既含离子键又含共价键的一种离子化合物的电子式 .
(2)含元素⑧的单质能与自来水中有机物反应生成对人体有危害的物质,现已逐步淘汰.下列可代替它作自来水消毒剂的是
A.NH2Cl B.AlCl3 C.K2FeO4 D.ClO2
(3)W与④是相邻的同主族元素.在下表中列出H2WO3的各种不同化学性质,举例并写出相应的化学方程式.
(4)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应: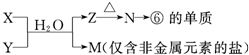
写出X溶液与Y溶液反应的离子方程式 ,
M中阳离子的鉴定方法 ,
如果M中含有元素⑧,M溶液中离子浓度由大到小的排列顺序是 .
查看习题详情和答案>>

(1)写出由④、⑤、⑧元素中形成的既含离子键又含共价键的一种离子化合物的电子式
(2)含元素⑧的单质能与自来水中有机物反应生成对人体有危害的物质,现已逐步淘汰.下列可代替它作自来水消毒剂的是
A.NH2Cl B.AlCl3 C.K2FeO4 D.ClO2
(3)W与④是相邻的同主族元素.在下表中列出H2WO3的各种不同化学性质,举例并写出相应的化学方程式.
| 编号 | 性质 | 化学方程式 |
| 示例 | 氧化性 | H2WO3+3H3PO3═3H3PO4+H2W↑ |
| 1 | ||
| 2 |

写出X溶液与Y溶液反应的离子方程式
M中阳离子的鉴定方法
如果M中含有元素⑧,M溶液中离子浓度由大到小的排列顺序是