题目内容
短周期元素X、Y、Z在元素周期表中的相对位置如下图所示.25℃,0.1mol?L-1 M溶液(M为Y的最高价氧化物所对应的水化物)的pH为13.
(1)Y的离子结构示意图为 .
(2)X、Z的气态氢化物稳定性较强的是 (填化学式).
(3)不能用带磨口玻璃塞的试剂瓶盛装M溶液的原因是 (用离子方程式表示).
(4)将X的最高价氧化物通入足量的M溶液中生成盐,该盐所含的化学键类型有 .
(5)工业上,用X单质制取Z单质的化学方程式为 .
(6)X的最高价氧化物与某一元有机酸的钾盐(化学式为KA,A-为酸根)溶液反应的化学方程式为 (已知25℃,X的最高价氧化物的水化物的电离常数为Ka1=4.2×10-7,Ka2=5.6×10-11,HA的电离常数Ka=1.1×10-10).
| X | |||
| Y | Z |
(2)X、Z的气态氢化物稳定性较强的是
(3)不能用带磨口玻璃塞的试剂瓶盛装M溶液的原因是
(4)将X的最高价氧化物通入足量的M溶液中生成盐,该盐所含的化学键类型有
(5)工业上,用X单质制取Z单质的化学方程式为
(6)X的最高价氧化物与某一元有机酸的钾盐(化学式为KA,A-为酸根)溶液反应的化学方程式为
分析:25℃,0.1mol?L-1 M溶液(M为Y的最高价氧化物所对应的水化物)的pH为13,说明M为强碱,由短周期元素X、Y、Z在元素周期表中的相对位置如,可推知Y是Na,X是C,Z是Si.
解答:解:25℃,0.1mol?L-1 M溶液(M为Y的最高价氧化物所对应的水化物)的pH为13,说明M为强碱,由短周期元素X、Y、Z在元素周期表中的相对位置如,可推知Y是Na,X是C,Z是Si,
(1)Y是Na,原子失去最外层1个电子形成钠离子,离子结构示意图为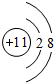 ,
,
故答案为: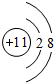 ;
;
(2)非金属性C>Si,故氢化物稳定性教强的是CH4,
故答案为:CH4;
(3)M是NaOH溶液,玻璃中含有二氧化硅,在瓶口会发生反应SiO2+2OH-═SiO32-+H2O,
故答案为:SiO2+2OH-═SiO32-+H2O;
(4)X的最高价氧化物为CO2,通入足量的NaOH溶液中生成Na2CO3,是含有共价键的离子化合物,含有共价键、离子键,
故答案为:共价键、离子键;
(5)工业上,在高温下用C单质还原二氧化硅反应制取Si单质,反应化学方程式为2C+SiO2
2CO↑+Si,
故答案为:2C+SiO2
2CO↑+Si;
(6)X的最高价氧化物的水化物的电离常数为Ka1=4.2×10-7,Ka2=5.6×10-11,HA的电离常数Ka=1.1×10-10,酸性H2CO3>HA>HCO3-,故X的最高价氧化物与KA反应生成KHCO3,故反应方程式为:KA+CO2+H2O═KHCO3+HA,
故答案为:KA+CO2+H2O═KHCO3+HA.
(1)Y是Na,原子失去最外层1个电子形成钠离子,离子结构示意图为
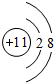 ,
,故答案为:
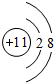 ;
;(2)非金属性C>Si,故氢化物稳定性教强的是CH4,
故答案为:CH4;
(3)M是NaOH溶液,玻璃中含有二氧化硅,在瓶口会发生反应SiO2+2OH-═SiO32-+H2O,
故答案为:SiO2+2OH-═SiO32-+H2O;
(4)X的最高价氧化物为CO2,通入足量的NaOH溶液中生成Na2CO3,是含有共价键的离子化合物,含有共价键、离子键,
故答案为:共价键、离子键;
(5)工业上,在高温下用C单质还原二氧化硅反应制取Si单质,反应化学方程式为2C+SiO2
| ||
故答案为:2C+SiO2
| ||
(6)X的最高价氧化物的水化物的电离常数为Ka1=4.2×10-7,Ka2=5.6×10-11,HA的电离常数Ka=1.1×10-10,酸性H2CO3>HA>HCO3-,故X的最高价氧化物与KA反应生成KHCO3,故反应方程式为:KA+CO2+H2O═KHCO3+HA,
故答案为:KA+CO2+H2O═KHCO3+HA.
点评:本题考查位置结构性质关系应用,涉及常用化学用语、元素化合物性质、化学键、电离常数应用等,难度中等,(6)中注意根据电离平衡常数判断产物.

练习册系列答案
相关题目
碱金属元素可形成离子型氢化物,下表是同一短周期元素X、Y、Z三种元素氢化物的某些性质
则这三种元素的原子序数从大到小的排列顺序为( )
| 元素 | 熔点(℃) | 沸点(℃) | 与水作用 | 纯液体的导电性 |
| X | -183 | -162 | 不与水反应也不溶于水 | 不导电 |
| Y | -102 | 19 | 放热,形成的酸是弱酸 | 不导电 |
| Z | 680 | - | 剧烈反应生成H2,溶液呈碱性 | 导电 |
| A、X、Y、Z |
| B、Z、X、Y |
| C、Y、X、Z |
| D、Z、Y、X |
短周期元素X、Y、Z、M、R在周期表中的相对位置如图所示.下列说法中不正确的是( )
| X | Y | ||||
| Z | M | R | |||
| A、元素X和Y可以形成两种以上的气态化合物 |
| B、原子半径的大小顺序为:r(Z)>r(M)>r(R) |
| C、元素的最高价氧化物对应水化物的酸性R强于M |
| D、加热蒸干由元素R和Z形成的化合物的水溶液可以得到该化合物的晶体 |
 短周期元素X、Y、Z在元素周期表中的位置如图所示,下列说法正确的是( )
短周期元素X、Y、Z在元素周期表中的位置如图所示,下列说法正确的是( )