题目内容
草酸三氢钾是一种无色晶体或白色粉末,加热至100℃失水成无水物,更高温度时分解为碳酸钾和一氧化碳等,溶于水,微溶于醇.实验室有一KH3(C2O4)2?2H2O样品(混有一定量的H2C2O4和K2SO4).现欲测定其纯度,请回答下列问题:
(1)完成并配平离子反应方程式:
(2)请完成相应的实验步骤:
步骤1:称取35.60g草酸三氢钾试样,加水溶解,配成250mL溶液.
步骤2:用移液管量取两份此溶液各25.00mL,分别置于两个锥形瓶中.
步骤3:第1份溶液加硫酸酸化后,用0.1000mol?L-1的高锰酸钾溶液滴定,至滴定终点消耗高锰酸钾溶液12.00mL.
步骤4:在第2份溶液中
(3)根据(2)中的实验步骤回答:
①步骤1用到的实验仪器有:电子天平、药匙、烧杯、玻璃棒、
②如何判断步骤3中的滴定终点?
③3.560g试样中含有还原剂(草酸根)的物质的量共为
(4)热重分析法(TG)是在程序控制温度下,测量物质的质量与温度的关系的一种实验技术.热重分析仪的基本构造由精密天平、程序控温加热炉和记录仪组成;记录仪画出剩余固体质量(m)~炉温(T)曲线,即热重(TG)曲线图.如图为CaC2O4?H2O在N2和O2气氛中的热重曲线.
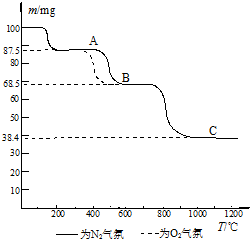
①C点所得固体的化学式为
②CaC2O4?H2O的分解分三个阶段,由图可看出,第二阶段在O2气氛中的反应速率要比在N2气氛中的快,原因是
(1)完成并配平离子反应方程式:
5
5
C2O42-+2
2
MnO4-+6
6
H+=10
10
CO2↑
CO2↑
+2
2
Mn2++8
8
H2O(2)请完成相应的实验步骤:
步骤1:称取35.60g草酸三氢钾试样,加水溶解,配成250mL溶液.
步骤2:用移液管量取两份此溶液各25.00mL,分别置于两个锥形瓶中.
步骤3:第1份溶液加硫酸酸化后,用0.1000mol?L-1的高锰酸钾溶液滴定,至滴定终点消耗高锰酸钾溶液12.00mL.
步骤4:在第2份溶液中
滴加酚酞试液
滴加酚酞试液
,用0.2500mol?L-1NaOH溶液滴定,至滴定终点消耗NaOH溶液20mL.(3)根据(2)中的实验步骤回答:
①步骤1用到的实验仪器有:电子天平、药匙、烧杯、玻璃棒、
250mL容量瓶
250mL容量瓶
、胶头滴管
胶头滴管
等.②如何判断步骤3中的滴定终点?
KMnO4最后一滴滴入溶液,溶液恰好变紫红色,且30s内不退色,此时便是滴定终点
KMnO4最后一滴滴入溶液,溶液恰好变紫红色,且30s内不退色,此时便是滴定终点
.③3.560g试样中含有还原剂(草酸根)的物质的量共为
0.3mol
0.3mol
.样品纯度为98.1%
98.1%
.(4)热重分析法(TG)是在程序控制温度下,测量物质的质量与温度的关系的一种实验技术.热重分析仪的基本构造由精密天平、程序控温加热炉和记录仪组成;记录仪画出剩余固体质量(m)~炉温(T)曲线,即热重(TG)曲线图.如图为CaC2O4?H2O在N2和O2气氛中的热重曲线.

①C点所得固体的化学式为
CaO
CaO
.②CaC2O4?H2O的分解分三个阶段,由图可看出,第二阶段在O2气氛中的反应速率要比在N2气氛中的快,原因是
氧气存在时第2步反应产生二氧化碳会抑制碳酸钙分解反应的进行
氧气存在时第2步反应产生二氧化碳会抑制碳酸钙分解反应的进行
(结合化学方程式回答).分析:(1)酸性条件下,草酸根离子能被高锰酸根离子氧化生成二氧化碳,同时高锰酸根离子被还原生成锰离子;
(2)用酚酞试液检验测定终点;
(3)①根据各仪器的作用选取仪器;
②高锰酸钾本身具有颜色,在滴定过程中可以担当指示剂的角色;
③根据草酸根离子和高锰酸钾之间的关系式计算;
(4)第1步反应为CaC2O4?xH2O失去结晶水生成CaC2O4,第2步反应为CaC2O4分解生成CaCO3与碳的氧化物,第3步,继续加热固体,碳酸钙分解生成氧化钙和二氧化碳.
(2)用酚酞试液检验测定终点;
(3)①根据各仪器的作用选取仪器;
②高锰酸钾本身具有颜色,在滴定过程中可以担当指示剂的角色;
③根据草酸根离子和高锰酸钾之间的关系式计算;
(4)第1步反应为CaC2O4?xH2O失去结晶水生成CaC2O4,第2步反应为CaC2O4分解生成CaCO3与碳的氧化物,第3步,继续加热固体,碳酸钙分解生成氧化钙和二氧化碳.
解答:解:(1)高锰酸钾具有强氧化性,在酸性环境下,能将草酸氧化为二氧化碳,同时自身被还原为锰离子,
根据得失电子数相等配平方程式,即:5C2O42-+2MnO4-+6H+=10CO2↑+2Mn2++8H2O
,故答案为:5,2,6,10CO2,2,8;
(2)碱滴定酸时用酚酞试液作指示剂,所以要在滴定液中滴加酚酞试液,故答案为:滴加酚酞试液;
(3)①用于配制溶液的250mL容量瓶、定容使用胶头滴管,故答案为:250mL容量瓶、胶头滴管;
②高锰酸钾本身具有颜色,在滴定草酸的过程中可以担当指示剂的角色,当最后一滴滴入溶液中,溶液恰好变紫红色,且30s内不退色,此时便是滴定终点,
故答案为:KMnO4最后一滴滴入溶液,溶液恰好变紫红色,且30s内不退色,此时便是滴定终点;
③根据5C2O42-+2MnO4-+6H+=10CO2↑+2Mn2++8H2O知,草酸根离子的物质的量=
×5×10=0.3mol,
根据氢氧化钠的物质的量计算草酸的物质的量=
×10=0.025mol,
根据碳原子守恒得KH3(C2O4)2?2H2O的物质的量=
mol=0.1375mol,
纯度=
×100%=98.%,
故答案为:0.3mol,98.1%;
(4)①加热过程中,草酸钙分解分三步,第1步反应为CaC2O4?xH2O失去结晶水生成CaC2O4,第2步反应为CaC2O4分解生成CaCO3与碳的氧化物,第3步,继续加热固体,碳酸钙分解生成氧化钙和二氧化碳,
所以C的固体是CaO,故答案为:CaO;
②在氧气氛围内,第2步产生的一氧化碳和氧气反应生成的二氧化碳,第2步产生的二氧化碳抑制碳酸钙分解,所以氧气存在时不利于第3步反应进行,
故答案为:氧气存在时第2步反应产生二氧化碳会抑制碳酸钙分解反应的进行.
根据得失电子数相等配平方程式,即:5C2O42-+2MnO4-+6H+=10CO2↑+2Mn2++8H2O
,故答案为:5,2,6,10CO2,2,8;
(2)碱滴定酸时用酚酞试液作指示剂,所以要在滴定液中滴加酚酞试液,故答案为:滴加酚酞试液;
(3)①用于配制溶液的250mL容量瓶、定容使用胶头滴管,故答案为:250mL容量瓶、胶头滴管;
②高锰酸钾本身具有颜色,在滴定草酸的过程中可以担当指示剂的角色,当最后一滴滴入溶液中,溶液恰好变紫红色,且30s内不退色,此时便是滴定终点,
故答案为:KMnO4最后一滴滴入溶液,溶液恰好变紫红色,且30s内不退色,此时便是滴定终点;
③根据5C2O42-+2MnO4-+6H+=10CO2↑+2Mn2++8H2O知,草酸根离子的物质的量=
| 0.1000mol/L×0.012L |
| 2 |
根据氢氧化钠的物质的量计算草酸的物质的量=
| 0.2500mol/L×0.02L |
| 2 |
根据碳原子守恒得KH3(C2O4)2?2H2O的物质的量=
| 0.3-0.025 |
| 2 |
纯度=
| 0.1375mol×254g/mol |
| 3.560g |
故答案为:0.3mol,98.1%;
(4)①加热过程中,草酸钙分解分三步,第1步反应为CaC2O4?xH2O失去结晶水生成CaC2O4,第2步反应为CaC2O4分解生成CaCO3与碳的氧化物,第3步,继续加热固体,碳酸钙分解生成氧化钙和二氧化碳,
所以C的固体是CaO,故答案为:CaO;
②在氧气氛围内,第2步产生的一氧化碳和氧气反应生成的二氧化碳,第2步产生的二氧化碳抑制碳酸钙分解,所以氧气存在时不利于第3步反应进行,
故答案为:氧气存在时第2步反应产生二氧化碳会抑制碳酸钙分解反应的进行.
点评:本题考查物质的量的有关计算及物质的确定,明确图象中曲线拐折的含义是解本题的关键,注意(3)中和高锰酸钾反应的草酸根离子包含草酸中的,为易错点,难度较大.

练习册系列答案
相关题目
