摘要:图(I)中瓶a内放入20毫升6摩/升盐酸.b是未充气的气球.里边放有4克碳酸钙粉末.将它紧紧套在瓶a口上.胶管c套在瓶的侧口.并用弹簧夹d夹紧.将图(I)的装 置在托盘天平上称量.质量为W1克. 根据实验现象填写下列空白: (1)把气球b中的碳酸钙粉末小心地倒入 瓶中.立即产生许多气泡.气球逐渐 胀大.反应结束后.再次称量. 质量为W2克.则W2和W1的关系 是 . (2)取25毫升6摩/升NaOH溶液.先用滴管取少量NaOH溶液.滴管插入胶管c口(为便于操作.可以适当倾斜瓶a.注意防止漏气).打开d.将溶液挤入瓶中.立即夹紧d.可以看到瓶内产生少量白色沉淀.轻轻摇动瓶a.沉淀随即消失.用同样方法再加入少量NaOH溶液.又产生白色沉淀.轻摇.沉淀又消失.使沉淀消失的反应的化学方程式是 . (3)将全部NaOH溶液很快加入瓶中.夹紧d.瓶内产生大量白色沉淀.不再溶解.此时瓶内温度 (填 “ 不变 .“降低 或“升高 ). (4)继续轻摇瓶a.气球逐渐缩小.直至恢复反应前的下垂状.写出这时发生的反应的化学方程式. .
网址:http://m.1010jiajiao.com/timu3_id_356483[举报]
黄铁矿(主要成分为FeS2)是我国大多数硫酸厂制取硫酸的主要原料.某化学学习小组对某黄铁矿石进行如下实验探究.
【实验一】测定硫元素的含量.
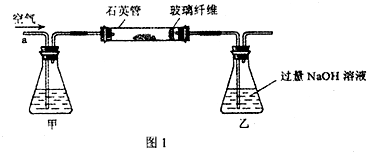
Ⅰ、将m1 g该黄铁矿样品放入如图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全.石英管中发生反应的化学方程式为:4FeS2+11O2
2Fe2O3+8SO2

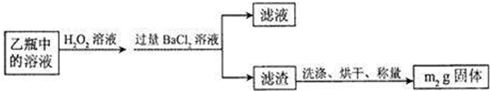
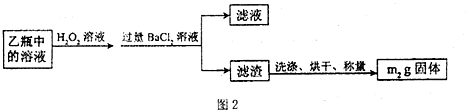
Ⅱ、反应结束后,将乙瓶中的溶液进行如下处理:

【实验二】测定铁元素的含量.
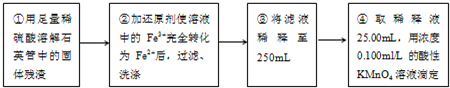
III、测定铁元素含量的实验步骤如图所示.
①用足量稀硫酸溶解石英管中的固体残渣②加还原剂使溶液中的Fe3+完全转化为Fe2+后,过滤、洗涤③将滤液稀释至250ml④取稀释液25.00mL,用已知浓度的酸性KMnO4溶液滴定
问题讨论:
(1)I中,甲瓶内所盛试剂是 溶液.乙瓶内发生反应的离子方程式有 .
(2)II中,所加H2O2溶液(氧化剂)需足量的理由是 .
(3)该黄铁矿中硫元素的质量分数为 .
(4)III的步骤②中,若选用铁粉作还原剂,你认为合理吗? ,理由是: .
(5)III的步骤③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有 .
查看习题详情和答案>>
【实验一】测定硫元素的含量.
Ⅰ、将m1 g该黄铁矿样品放入如图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全.石英管中发生反应的化学方程式为:4FeS2+11O2
| ||

Ⅱ、反应结束后,将乙瓶中的溶液进行如下处理:

【实验二】测定铁元素的含量.
III、测定铁元素含量的实验步骤如图所示.
①用足量稀硫酸溶解石英管中的固体残渣②加还原剂使溶液中的Fe3+完全转化为Fe2+后,过滤、洗涤③将滤液稀释至250ml④取稀释液25.00mL,用已知浓度的酸性KMnO4溶液滴定
问题讨论:
(1)I中,甲瓶内所盛试剂是
(2)II中,所加H2O2溶液(氧化剂)需足量的理由是
(3)该黄铁矿中硫元素的质量分数为
(4)III的步骤②中,若选用铁粉作还原剂,你认为合理吗?
(5)III的步骤③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有
黄铁矿(主要成分为FeS2)是我国大多数硫酸厂制取硫酸的主要原料.某化学学习小组对某黄铁矿石进行如下实验探究.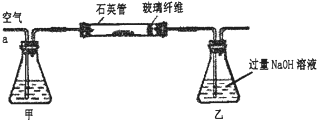
[实验一]测定硫元素的含量.
Ⅰ、将m1g该黄铁矿样品放入如右图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全.石英管中发生反应的化学方程式为:4FeS2+11O2═2Fe2O3+8SO2
Ⅱ、反应结束后,将乙瓶中的溶液进行如下处理:
[实验二]测定铁元素的含量.
III、测定铁元素含量的实验步骤如图所示.
问题讨论:
(1)I中,甲瓶内所盛试剂是
(2)II中,乙瓶加入H2O2溶液时反应的离子方程式为
(3)该黄铁矿中硫元素的质量分数为
×100%
×100%.
(4)III的步骤③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有
(5)III的步骤④中,表示滴定已达终点的现象是
(6)Ⅲ的步骤④进行了三次平行实验,测得消耗KMnO4溶液体积分别为24.98mL、24.80mL、25.02mL(KMnO4被还原为Mn2+).根据上述数据,可计算出该黄铁矿样品铁元素的质量分数为
.
查看习题详情和答案>>

[实验一]测定硫元素的含量.
Ⅰ、将m1g该黄铁矿样品放入如右图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全.石英管中发生反应的化学方程式为:4FeS2+11O2═2Fe2O3+8SO2
Ⅱ、反应结束后,将乙瓶中的溶液进行如下处理:

[实验二]测定铁元素的含量.
III、测定铁元素含量的实验步骤如图所示.

问题讨论:
(1)I中,甲瓶内所盛试剂是
NaOH
NaOH
溶液.乙瓶内发生反应的离子方程式为SO2+2OH-=SO32-+H2O、2SO32-+O2=2SO42-
SO2+2OH-=SO32-+H2O、2SO32-+O2=2SO42-
.(2)II中,乙瓶加入H2O2溶液时反应的离子方程式为
SO32-+H2O2═SO42-+H2O
SO32-+H2O2═SO42-+H2O
.(3)该黄铁矿中硫元素的质量分数为
| 32m2 |
| 233m1 |
| 32m2 |
| 233m1 |
(4)III的步骤③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有
250ml容量瓶
250ml容量瓶
.(5)III的步骤④中,表示滴定已达终点的现象是
最后一滴高锰酸钾溶液滴入时,溶液颜色突变为紫色,且在30s内不变色
最后一滴高锰酸钾溶液滴入时,溶液颜色突变为紫色,且在30s内不变色
.(6)Ⅲ的步骤④进行了三次平行实验,测得消耗KMnO4溶液体积分别为24.98mL、24.80mL、25.02mL(KMnO4被还原为Mn2+).根据上述数据,可计算出该黄铁矿样品铁元素的质量分数为
| 7 |
| m1 |
| 7 |
| m1 |
黄铁矿(主要成分为FeS2)是我国大多数硫酸厂制取的主要原料.某化学学习小组对黄铁矿石进行如下实验探究:
[实验一]为测定硫元素的含量
I.将m1g该黄铁矿样品放入如图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全.

Ⅱ.反应结束后,将乙瓶中的溶液进行如下处理:

问题讨论:
(1)I中,甲瓶内所盛试剂是
(2)Ⅱ中,所需H2O2溶液足量的理由是
(3)该黄铁矿石中硫元素的质量分数为
×100%
×100%.
[实验二]:设计以下实验方案测定铁元素的含量

问题讨论:
(4)②中,若选用铁粉作还原剂.你认为合理吗?
若不合理,会如何影响测量结果:
(5)③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有
(6)④中发生反应的离子方程式为
查看习题详情和答案>>
[实验一]为测定硫元素的含量
I.将m1g该黄铁矿样品放入如图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全.

Ⅱ.反应结束后,将乙瓶中的溶液进行如下处理:

问题讨论:
(1)I中,甲瓶内所盛试剂是
氢氧化钠或氢氧化钾
氢氧化钠或氢氧化钾
溶液.乙瓶内发生反应的离子方程式有SO2+2OH-=SO32-+H2O
SO2+2OH-=SO32-+H2O
、2SO32-+O2=2SO42-
2SO32-+O2=2SO42-
.(2)Ⅱ中,所需H2O2溶液足量的理由是
使SO32-完全氧化为SO42-
使SO32-完全氧化为SO42-
.(3)该黄铁矿石中硫元素的质量分数为
| 32m2 |
| 233m1 |
| 32m2 |
| 233m1 |
[实验二]:设计以下实验方案测定铁元素的含量

问题讨论:
(4)②中,若选用铁粉作还原剂.你认为合理吗?
不合理
不合理
.若不合理,会如何影响测量结果:
会使所测得的铁元素的质量分数偏大
会使所测得的铁元素的质量分数偏大
(若合理,此空不答).(5)③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有
250mL容量瓶
250mL容量瓶
.(6)④中发生反应的离子方程式为
5Fe2++MnO4ˉ+8H+=Mn2++5Fe3++4H2O
5Fe2++MnO4ˉ+8H+=Mn2++5Fe3++4H2O
.铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与H2SPO4反应).某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究.

Ⅰ.铁矿石中含氧量的测定
①按如图组装仪器,检查装置的气密性;
②将5.0g铁矿石放入硬质玻璃管中,装置B、C中的药品如图所示(夹持仪器均省略):
③从左端导气管口处不断地缓缓通入H2,待C装置出口处H2验纯后,点燃A处酒精灯;
④充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却.
(1)装置C的作用为 .
(2)测得反应后装置B增重1.35g,则铁矿石中氧的百分含量为 .
(3)若将H2换成CO,则还需补充 装置.
Ⅱ.铁矿石中含铁量的测定
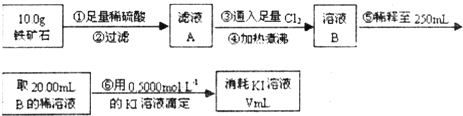
(4)步骤④中煮沸的作用是 .
(5)步骤⑤中用到的玻璃仪器除烧杯、玻璃棒、胶头滴管外,还有 .
(6)下列有关步骤⑥的操作中说法正确的是 .
a.因为碘水为黄色,所以滴定过程中不需加指示剂
b.滴定过程中可利用淀粉溶液作为指示剂
c.滴定管用蒸馏水洗涤后可以直接装液
d.锥形瓶不需要用待测液润洗
e.滴定过程中,眼睛注视滴定管中液面变化
f.滴定结束后,30s内溶液不恢复原来的颜色,再读数
(7)若滴定过程中消耗0.5000mol?L-1的KI溶液20.00mL,则铁矿石中铁的百分含量为 .
Ⅲ.(8)由I、II可以推算出该铁矿石中铁的氧化物的化学式 .
查看习题详情和答案>>

Ⅰ.铁矿石中含氧量的测定
①按如图组装仪器,检查装置的气密性;
②将5.0g铁矿石放入硬质玻璃管中,装置B、C中的药品如图所示(夹持仪器均省略):
③从左端导气管口处不断地缓缓通入H2,待C装置出口处H2验纯后,点燃A处酒精灯;
④充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却.
(1)装置C的作用为
(2)测得反应后装置B增重1.35g,则铁矿石中氧的百分含量为
(3)若将H2换成CO,则还需补充
Ⅱ.铁矿石中含铁量的测定

(4)步骤④中煮沸的作用是
(5)步骤⑤中用到的玻璃仪器除烧杯、玻璃棒、胶头滴管外,还有
(6)下列有关步骤⑥的操作中说法正确的是
a.因为碘水为黄色,所以滴定过程中不需加指示剂
b.滴定过程中可利用淀粉溶液作为指示剂
c.滴定管用蒸馏水洗涤后可以直接装液
d.锥形瓶不需要用待测液润洗
e.滴定过程中,眼睛注视滴定管中液面变化
f.滴定结束后,30s内溶液不恢复原来的颜色,再读数
(7)若滴定过程中消耗0.5000mol?L-1的KI溶液20.00mL,则铁矿石中铁的百分含量为
Ⅲ.(8)由I、II可以推算出该铁矿石中铁的氧化物的化学式
黄铁矿(主要成分为FeS2)是我国大多数硫酸厂制取的主要原料.某化学学习小组对黄铁矿石进行如下实验探究:
[实验一]为测定硫元素的含量
I.将m1g该黄铁矿样品放入如图1所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全.
II.反应结束后,将乙瓶中的溶液进行如图2处理.
[实验二]测定铁元素的含量.III.测定铁元素含量的实验步骤如下:
①用足量稀硫酸溶解石英管中的固体残渣;
②加还原剂使溶液中的Fe3+完全转化为Fe2+后,过滤、洗涤;
③将滤液稀释至250mL;
④每次取稀释液25.00mL,用已知物质的量浓度为cmol/L的酸性KMnO4溶液滴定,三次滴定实验所需KMnO4溶液体积的平均值为VmL(该反应中还原产物为Mn2-)
请完成下列填空:
(1)已知12gFeS2完全燃烧放热85.3kJ,则FeS2燃烧热的化学方程式是
(2)I中,甲瓶内所盛试剂是
(3)II中的滤渣在称量前还应进行的操作是
(4)III的步骤③中,需要用到的仪器除烧杯、玻璃棒外,还有
(5)该黄铁矿中硫元素的质量分数
×100%
×100%(用I、II中有关实验数据表达);该黄铁矿中铁的元素的质量分数
×100%
×100%(用I、II中有关实验数据表达)
查看习题详情和答案>>
[实验一]为测定硫元素的含量
I.将m1g该黄铁矿样品放入如图1所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全.

II.反应结束后,将乙瓶中的溶液进行如图2处理.

[实验二]测定铁元素的含量.III.测定铁元素含量的实验步骤如下:
①用足量稀硫酸溶解石英管中的固体残渣;
②加还原剂使溶液中的Fe3+完全转化为Fe2+后,过滤、洗涤;
③将滤液稀释至250mL;
④每次取稀释液25.00mL,用已知物质的量浓度为cmol/L的酸性KMnO4溶液滴定,三次滴定实验所需KMnO4溶液体积的平均值为VmL(该反应中还原产物为Mn2-)
请完成下列填空:
(1)已知12gFeS2完全燃烧放热85.3kJ,则FeS2燃烧热的化学方程式是
FeS2(s)+
O2(g)═
Fe2O3(s)+2SO2(g)△H=-853kJ/mol
| 11 |
| 4 |
| 1 |
| 2 |
FeS2(s)+
O2(g)═
Fe2O3(s)+2SO2(g)△H=-853kJ/mol
.| 11 |
| 4 |
| 1 |
| 2 |
(2)I中,甲瓶内所盛试剂是
NaOH
NaOH
溶液;乙瓶内发生反应的离子方程式有2OH-+SO2═SO32-+H2O
2OH-+SO2═SO32-+H2O
;I中玻璃纤维的作用是防止粉尘进入导管和乙装置
防止粉尘进入导管和乙装置
.(3)II中的滤渣在称量前还应进行的操作是
洗涤、干燥
洗涤、干燥
;II中,所加H2O2溶液需足量的理由是使SO32- 完全转化成SO42-
使SO32- 完全转化成SO42-
.(4)III的步骤③中,需要用到的仪器除烧杯、玻璃棒外,还有
250ml容量瓶
250ml容量瓶
;④中取稀释液25.00mL需用的仪器是酸式滴定管
酸式滴定管
.(5)该黄铁矿中硫元素的质量分数
| 32m2 |
| 233m1 |
| 32m2 |
| 233m1 |
| 2.8CV |
| m1 |
| 2.8CV |
| m1 |