题目内容
[实验一]为测定硫元素的含量
I.将m1g该黄铁矿样品放入如图1所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全.
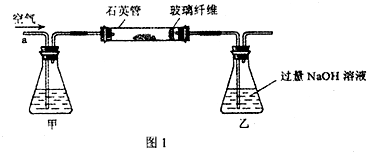
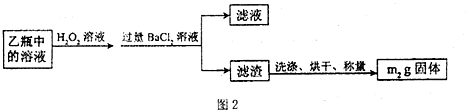
II.反应结束后,将乙瓶中的溶液进行如图2处理.
[实验二]测定铁元素的含量.III.测定铁元素含量的实验步骤如下:
①用足量稀硫酸溶解石英管中的固体残渣;
②加还原剂使溶液中的Fe3+完全转化为Fe2+后,过滤、洗涤;
③将滤液稀释至250mL;
④每次取稀释液25.00mL,用已知物质的量浓度为cmol/L的酸性KMnO4溶液滴定,三次滴定实验所需KMnO4溶液体积的平均值为VmL(该反应中还原产物为Mn2-)
请完成下列填空:
(1)已知12gFeS2完全燃烧放热85.3kJ,则FeS2燃烧热的化学方程式是
| 11 |
| 4 |
| 1 |
| 2 |
| 11 |
| 4 |
| 1 |
| 2 |
(2)I中,甲瓶内所盛试剂是
(3)II中的滤渣在称量前还应进行的操作是
(4)III的步骤③中,需要用到的仪器除烧杯、玻璃棒外,还有
(5)该黄铁矿中硫元素的质量分数
| 32m2 |
| 233m1 |
| 32m2 |
| 233m1 |
| 2.8CV |
| m1 |
| 2.8CV |
| m1 |
(2)为防止最后乙溶液中混有BaCO3沉淀而影响实验结果,应将空气中的二氧化碳除去,所以甲装置中可用NaOH溶液,过量NaOH溶液与SO2反应生成SO32-和H2O,离子方程式为2OH-+SO2═SO32-+H2O;反应中可用玻璃纤维防止粉尘进入导管和乙装置;
(3)为准确称量固体的质量,在称量之前需洗涤和干燥;为减少实验误差,最后使完全转化成SO42-,从而完全生成硫酸钡沉淀;
(4)配制250ml一定物质的量浓度的溶液需要烧杯、玻璃棒、胶头滴管、量筒、250ml容量瓶等仪器,高锰酸钾溶液具有强氧化性,应用酸式滴定管量取;
(5)根据硫元素守恒和铁元素守恒计算质量分数.
| 11 |
| 4 |
| 1 |
| 2 |
(2)为防止最后乙溶液中混有BaCO3沉淀而影响实验结果,应将空气中的二氧化碳除去,所以甲装置中可用NaOH溶液,过量NaOH溶液与SO2反应生成SO32-和水H2O,离子方程式为2OH-+SO2═SO32-+H2O;反应中可用玻璃纤维防止粉尘进入导管和乙装置,故答案为:NaOH;2OH-+SO2═SO32-+H2O;防止粉尘进入导管和乙装置;
(3)为准确称量固体的质量,在称量之前需洗涤和干燥;为减少实验误差,最后使完全转化成SO42-,从而完全生成硫酸钡沉淀,故答案为:洗涤、干燥;使SO32- 完全转化成SO42-;
(4)配制250ml一定物质的量浓度的溶液需要烧杯、玻璃棒、胶头滴管、量筒、250ml容量瓶等仪器,高锰酸钾溶液具有强氧化性,应用酸式滴定管量取.答案为:250ml 容量瓶; 酸式滴定管;
(5)根据硫元素守恒,m1gFeS2中的硫元素最终全部生成BaSO4,则有:n(BaSO4)=
| m2 |
| 233 |
| m2 |
| 233 |
| m2 |
| 233 |
| 32m2 |
| 233m1 |
MnO4-~5Fe2+
CV×10-3mol 5CV×10-3mol,
则原样品中含铁元素的质量为:
| 5CV× 10-3×10mol× 56g/mol |
| m1 |
| 2.8CV |
| m1 |
故答案为:
| 32m2 |
| 233m1 |
| 2.8CV |
| m1 |

| |||||||||||||||||||
硫酸渣是用黄铁矿制造硫酸过程中排出的废渣,主要化学成分为SiO2约45%,Fe2O3约40%,Al2O3约10%,MgO约5%。目前我国已经在技术上取得突破——从硫酸渣中分离出各种成分并加以利用。其流程和相关数据如下:

查资料得知:
|
物质名称 |
溶度积(Ksp) |
pH值 |
|
|
开始沉淀 |
完全沉淀 |
||
|
Mg(OH)2 |
5.6×10-12 |
9.3 |
10.8 |
|
Fe(OH)3 |
2.8×10-16 |
2.7 |
3.7 |
|
Al(OH)3 |
1.3×10-33 |
3.7 |
4.7 |
请回答下列问题:
(1)写出固体A的化学式为 。
(2)若要测定溶液的pH是否达到3.7,下列实验用品中可选用的是 。
A.石蕊试液 B.广泛pH试纸 C.精密pH试纸 D.pH计
(3)完成下列离子反应方程式
①溶液D生成固体E ; ②溶液F生成固体G 。
(4)要将固体C、固体E和固体G都转化为相应的稳定氧化物,需进行的实验操作为 。
(5)若不考虑溶液体积的变化,请计算溶液H中c(Mg2+)= 。