网址:http://m.1010jiajiao.com/timu3_id_33251[举报]
实验用品:硫酸铜晶体、研钵、干燥器、坩埚、三脚架、玻璃棒、药匙、托盘天平
实验步骤:
① 准确称量一个干净、干燥的坩埚;
② 在坩埚中加入一定量的硫酸铜晶体试样,称重,将称量的试样放入研钵中研细,再放回到坩埚中;
③ 将盛有试样的坩埚加热,待晶体变成白色粉末时,停止加热;
④ 将步骤③中的坩埚放入干燥器,冷却至室温后,称重;
⑤ 将步骤④中的坩埚再加热一定时间,放入干燥器中冷却至室温后称量。重复本操作,直至连续两次称量的质量差不超过0.1g为止;
⑥ 计算硫酸铜晶体化学式中x的实验值。
分析该方案并回答下面问题:
(1)完成本实验还需要的实验用品是___________ ;
(2) 指出实验步骤②中存在的错误并改正:_______________ ;
(3)硫酸铜不能放置在空气中冷却的原因是 _______________;
(4)步骤⑤的目的是________________ ;
(5)若坩埚的质量为m,坩埚与硫酸铜晶体的质量为m1,加热后称量坩埚与无水硫酸铜的质量为m2,则晶体CuSO4·xH2O中,x =______________ (写表达式);
(6)下面的情况有可能造成测试结果偏高的是 ____________(填序号)。
A.试样中含有加热不挥发的杂质
B.试样中含有加热易挥发的杂质
C.测试前试样已有部分脱水
D.实验前坩埚未完全干燥
E.晶体加热脱水不完全
F.加热时有晶体溅出
以下是某同学测定硫酸铜晶体(CuSO4·xH2O)中结晶水含量的实验方案。
实验用品:硫酸铜晶体、研钵、干燥器、坩埚、三脚架、玻璃棒、药匙、托盘天平
实验步骤:
① 准确称量一个干净、干燥的坩埚;
② 在坩埚中加入一定量的硫酸铜晶体试样,称重,将称量的试样放入研钵中研细,再放回到坩埚中;
③ 将盛有试样的坩埚加热,待晶体变成白色粉末时,停止加热;
④ 将步骤③中的坩埚放入干燥器,冷却至室温后,称重;
⑤ 将步骤④中的坩埚再加热一定时间,放入干燥器中冷却至室温后称量。重复本操作,直至连续两次称量的质量差不超过0.1g为止;
⑥ 计算硫酸铜晶体化学式中x的实验值。
分析该方案并回答下面问题:
(1)完成本实验还需要的实验用品是 ;
(2) 指出实验步骤②中存在的错误并改正: ;
(3)硫酸铜不能放置在空气中冷却的原因是 ;
(4)步骤⑤的目的是 ;
(5)若坩埚的质量为m,坩埚与硫酸铜晶体的质量为m1,加热后称量坩埚与无水硫酸铜的质量为m2,则晶体CuSO4·xH2O中,x = (写表达式);
(6)下面的情况有可能造成测试结果偏高的是 (填序号)。
A.试样中含有加热不挥发的杂质 B.试样中含有加热易挥发的杂质
C.测试前试样已有部分脱水 D.实验前坩埚未完全干燥
E.晶体加热脱水不完全 F.加热时有晶体溅出
查看习题详情和答案>>(1)制备氧化铜
① 将工业硫酸铜加适量水溶解、搅拌、过滤除去不溶性杂质。简述检验滤液中含有Fe2+的操作方法:____________________________。
② 向滤液中滴加H2O2溶液,稍加热,当Fe2+转化完全后,为将Fe3+全部转化为Fe(OH)3沉淀,而不会将
Cu2+转化为沉淀,需慢慢加入Cu2(OH)2CO3粉末,搅拌,以控制溶液pH=3.5。加热煮沸后过滤,用稀硫酸酸化滤液至pH=1。再从溶液中分离出硫酸铜晶体。Fe2+转化为Fe3+的离子方程式是______________。
③ 在测定所得硫酸铜晶体(CuSO4·xH2O)x值的实验中,所用的玻璃仪器名称为:酒精灯、玻璃棒、_______________,实验过程中称量操作至少进行_______次。
④ 用得到的硫酸铜晶体制氧化铜。
(2)探究氧化铜的性质
在加热条件下,向下图所示装置中持续通入某纯净物X的蒸气,a处黑色物质变为红色, b处白色粉末变为蓝色,c处有无色液体产生。(设各步反应均进行完全)

 实验室用浓硫酸与铜的反应制取少量 NaHSO3,实验装置如图所示.请回答:
实验室用浓硫酸与铜的反应制取少量 NaHSO3,实验装置如图所示.请回答:(1)实验中取一定量Cu片和一定量浓H2SO4放在圆底烧瓶中共热,至反应结束后,发现烧瓶中还有少量Cu剩余,则H2SO4 是否剩余
(2)向反应后的溶液中加入足量的CuO,过滤后将滤液加热浓缩,冷却结晶制得硫酸铜晶体(CuSO4?xH2O)某小组同学采用加热法测定该晶体里结晶水 x 的值;
①在他们的每次实验操作中至少称量
③加热法测定该晶体里结晶水 x 的值,结晶水完全失去的判断方法是
④下面是三次实验数据的平均值
| 坩埚质量 | 坩埚与晶体总质量 | 加热后坩埚与固体总质量 |
| 11.7g | 22.7g | 18.6g |
(3)下列说法正确的是:
a.甲装置使用的玻璃仪器有:酒精灯、玻璃管、长颈漏斗、圆底烧瓶;
b.KMnO4溶液用于尾气处理;
c.当把品红溶液滴入到锥形瓶中,若品红不褪色,说明无NaHSO3产生;
d.当把品红溶液滴入到锥形瓶中,若品红褪色,说明NaOH已完全转化为NaHSO3;
e.若把品红溶液换成酸性高锰酸钾溶液,并滴入到锥形瓶中,不显紫红色,说明NaOH已完全转化为NaHSO3.
某研究小组用如图所示装置进行铜与浓硫酸反应的实验研究.
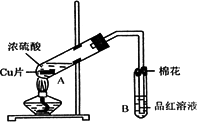
(1)写出试管B中的实验现象________.
(2)写出A中反应的化学方程式________
(3)继续向A试管中加入H2O2,发现铜片溶解,反应的离子方程式为:________.若仍不补充浓硫酸,只要求使铜片溶解,也可以加入(填写两种属于不同类别物质的化学式)________、________.
(4)B试管口的棉花应沾有的试剂是________.
(5)小组成员向反应后的溶液中加入足量的氧化铜,使剩余的硫酸全部转化为硫酸铜,过滤后,将滤液加热浓缩,冷却结晶制得硫酸铜晶体(CuSO4·xH2O).小组成员采用加热法测定该晶体里结晶水x的值.
①在他们的实验操作中,至少称量________次;
②下面是其中一次实验的数据:
根据上表数据计算判断x的实侧值比理论值(x=5)________(填“偏大”、“偏小”),这次实验中产生误差的原因可能是________(填序号)
A.硫酸铜晶体中含有不挥发的杂质
B.实验前晶体表面有湿存水
C.加热时有晶体飞溅出去
D.加热失水后露置在空气中冷却