题目内容
 实验室用浓硫酸与铜的反应制取少量 NaHSO3,实验装置如图所示.请回答:
实验室用浓硫酸与铜的反应制取少量 NaHSO3,实验装置如图所示.请回答:(1)实验中取一定量Cu片和一定量浓H2SO4放在圆底烧瓶中共热,至反应结束后,发现烧瓶中还有少量Cu剩余,则H2SO4 是否剩余
(2)向反应后的溶液中加入足量的CuO,过滤后将滤液加热浓缩,冷却结晶制得硫酸铜晶体(CuSO4?xH2O)某小组同学采用加热法测定该晶体里结晶水 x 的值;
①在他们的每次实验操作中至少称量
③加热法测定该晶体里结晶水 x 的值,结晶水完全失去的判断方法是
④下面是三次实验数据的平均值
| 坩埚质量 | 坩埚与晶体总质量 | 加热后坩埚与固体总质量 |
| 11.7g | 22.7g | 18.6g |
(3)下列说法正确的是:
a.甲装置使用的玻璃仪器有:酒精灯、玻璃管、长颈漏斗、圆底烧瓶;
b.KMnO4溶液用于尾气处理;
c.当把品红溶液滴入到锥形瓶中,若品红不褪色,说明无NaHSO3产生;
d.当把品红溶液滴入到锥形瓶中,若品红褪色,说明NaOH已完全转化为NaHSO3;
e.若把品红溶液换成酸性高锰酸钾溶液,并滴入到锥形瓶中,不显紫红色,说明NaOH已完全转化为NaHSO3.
(2)①实验中为准确测定结晶水的值,应分别测定坩埚的质量、坩埚与晶体的总质量,以此测定晶体的质量,然后称量加热后坩埚与固体总质量,之后再加热一次以判断晶体是否完全分解,总共称量4次;
③加热至恒重,两次称量质量不超过0.1g;
④根据表中数据计算硫酸铜和结晶水的物质的量,进而计算x值;
(3)a、装置中是分液漏斗;
b、高锰酸钾溶液可以吸收二氧化硫;
c、溶液中如果溶有SO2则品红褪色,若无SO2则不褪色,但并不能说明无NaHSO3;
d、溶液中如果溶有SO2则品红褪色,若无SO2则不褪色,但并不能说明无NaHSO3;
e、亚硫酸钠、亚硫酸氢钠、二氧化硫都可以和高锰酸钾反应.
故答案为:剩余;稀H2SO4与Cu不反应,随着反应进行,H2SO4越来越稀,所以H2SO4一定有剩余;
(2)①实验中为准确测定结晶水的值,应分别测定坩埚的质量、坩埚与晶体的总质量,以此测定晶体的质量,然后称量加热后坩埚与固体总质量,之后再加热一次以判断晶体是否完全分解,总共称量4次,故答案为:4;
③依据实验基本操作,物质加热失水至恒重最后两次称量的质量差不超过0.1g,故答案为:两次称量不超过0.1g;
④该实验晶体的质量为22.7g-11.7g=11g,硫酸铜的质量为18.6g-11.7g=6.9g,水的质量为22.7g-18.6g=4.1g,则n(CuSO4)=
| 6.9g |
| 160g/mol |
n(H2O)=
| 4.1g |
| 18g/mol |
| 0.23 |
| 0.043 |
(3)a.甲装置使用的玻璃仪器有:酒精灯、玻璃管、分液漏斗、圆底烧瓶,故a错误;
b.KMnO4溶液用于尾气处理,二氧化硫是污染性气体不能排放到大气中,高锰酸钾溶液可以吸收二氧化硫,故b正确;
c.当把品红溶液滴入到锥形瓶中,溶液中如果溶有SO2则品红褪色,若无SO2则不褪色,但并不能说明无NaHSO,3.故c错误;
d.当把品红溶液滴入到锥形瓶中,若品红褪色,说明溶液中含有二氧化硫,过量的二氧化硫和氢氧化钠全部反应,说明NaOH已完全转化为NaHSO3,故d正确;
e.若把品红溶液换成酸性高锰酸钾溶液,并滴入到锥形瓶中,不显紫红色,高锰酸钾发生反应,其中亚硫酸钠、亚硫酸氢钠、二氧化硫都可以和高锰酸钾反应,不能说明NaOH已完全转化为NaHSO3,故e错误;
故答案为:bd.

 科学实验活动册系列答案
科学实验活动册系列答案 实验室用浓硫酸与铜的反应制取少量NaHSO3,实验装置如图所示:
实验室用浓硫酸与铜的反应制取少量NaHSO3,实验装置如图所示:请回答:
(1)实验中取一定量Cu片和一定量浓H2SO4放在圆底烧瓶中共热,至反应结束后,发现烧瓶中还有少量Cu剩余,则H2SO4 是否剩余
(2)向反应后的溶液中加入足量的CuO,过滤后将滤液加热浓缩,冷却结晶制得硫酸铜晶体(CuSO4?XH2O)某小组同学采用加热法测定该晶体里结晶水X的值;
①冷却结晶后要获得较纯净的硫酸铜晶体采取的操作是
②在他们的每一次实验操作中至少称量
③加热法测定该晶体里结晶水X的值,结晶水完全失去的判断方法是
④下面是三次实验数据的平均值
| 坩埚质量 | 坩埚与晶体总质量 | 加热后坩埚与固体总质量 |
| 11.7g | 22.7g | 18.6g |
(3)装置乙的作用是:
(4)下列说法正确的是:
a.甲装置使用的玻璃仪器有:酒精灯、玻璃管、长颈漏斗、圆底烧瓶
b.KMnO4溶液用于尾气处理
c.当把品红溶液滴入到锥形瓶中,若品红不褪色,说明无NaHSO3产生
d.当把品红溶液滴入到锥形瓶中,若品红褪色,说明NaOH已完全转化为NaHSO3
e.若把品红溶液换成酸性高锰酸钾溶液,并滴入到锥形瓶中,不显紫红色,说明NaOH已完全转化为NaHSO3.
(14分)实验室用浓硫酸与铜的反应制取少量NaHSO3,实验装置如下图所示:
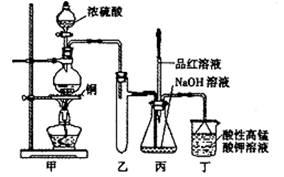
请回答:
(1)实验中取一定量Cu片和一定量浓H2SO4放在圆底烧瓶中共热,至反应结束后,发现烧瓶中还有少量Cu剩余,有人认为还有一定量的H2SO4剩余,原因是
,在不增加浓H2SO4的前提下,若使剩余铜片溶解可再加入 (填写两种属于不同类别的物质)。
(2)向反应后的溶液中加入足量的CuO,使剩余的H2SO4全部转化为CuSO4,过滤后将滤液加热浓缩,冷却结晶制得硫酸铜晶体(CuSO4·XH2O)某小组同学采用加热法测定该晶体里结晶水X的值;
①在他们的实验操作中至少称量 次。
②下面是其中一次实验的数据
| 坩埚质量 | 坩埚与晶体总质量 | 加热后坩埚与固体总质量 |
| 11.7g | 22.7g | 18.6g |
根据上表数据计算判断x的实测值比理论值(x=5) (填“偏大”或“偏小”)。
(3)装置乙的作用是: ;
(4)下列说法正确的是: (填序号)。
a.甲装置使用的玻璃仪器有:酒精灯、玻璃管、长颈漏斗、圆底烧瓶
b.KMnO4溶液用于尾气处理
c.当把品红溶液滴入到锥形瓶中,若品红不褪色,说明无NaHSO3产生
d.当把品红溶液滴入到锥形瓶中,若品红褪色,说明NaOH已完全转化为NaHSO3
e.若把品红溶液换成酸性高锰酸钾溶液,并滴入到锥形瓶中,不显紫红色,说明NaOH已完全转化为NaHSO3
f.此装置换上其它药品后,不能制取和收集少量纯净的氯气
 实验室用浓硫酸与铜的反应制取少量NaHSO3,实验装置如图所示:
实验室用浓硫酸与铜的反应制取少量NaHSO3,实验装置如图所示: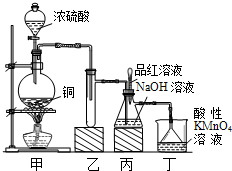 实验室用浓硫酸与铜的反应制取少量NaHSO3,实验装置如图所示:
实验室用浓硫酸与铜的反应制取少量NaHSO3,实验装置如图所示: