摘要:关于甲醛的高¥考^资@源*网下列说法中错误的是( ) A.甲醛是最简单的一种醛.易溶解于水 甲醛是一种无色.有刺激性气味的气体 C.甲醛的水溶液被称之为福尔马林 D.福尔马林有杀菌.防腐性能.所以市场上可用来浸泡海产品高¥考^资@源*网等
网址:http://m.1010jiajiao.com/timu3_id_304417[举报]
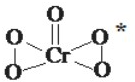 (1)氧元素与多种元素具有亲和力,所形成化合物的种类很多.
(1)氧元素与多种元素具有亲和力,所形成化合物的种类很多.①氧元素和过渡元素可形成多种价态的金属氧化物,如和铬可生成Cr2O3、CrO3、CrO5等.其中CrO5的结构式如图所示,请写出该物质中铬元素的化合价为
②氧元素可以和氢元素形成原子个数比为1:1的分子,该物质在酸性条件下与Fe2+发生反应的离子方程式为
③氧元素还可以形成多种离子,在NO2+中氮原子轨道杂化类型是
(2)请回答下列问题:
①解释CO2为直线形分子的原因
②为减少温室效应,科学家设计反应:CO2+4H2═CH4+2H2O以减小空气中CO2.若有1mol CH4生成,则有
③甲醇的沸点比甲醛的高,其主要原因是
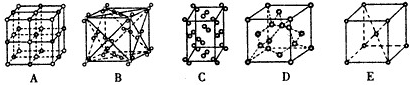
(3)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序).与冰的晶体结构相符的是
 查看习题详情和答案>>
查看习题详情和答案>>
国内某知名媒体报道,国内啤酒生产企业中95%以上在生产过程中都填加了甲醛作为舔加剂,在啤酒行业内引起极大反响.下列关于甲醛的说法中正确的是( )
| A、甲醛分子组成中仅有C、H两种元素 | B、甲醛是一种无色无味的气体,对人体无危害,所以,可以放心饮用啤酒 | C、甲醛既可以被氧化生成甲酸、也可以还原生成甲醇 | D、甲醛的化学性质很稳定,很难与强酸、强碱、强氧化剂反应 |
 生物质能是一种洁净、可再生的能源.生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一.
生物质能是一种洁净、可再生的能源.生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一.(1)上述反应的催化剂含有Cu、Zn、Al等元素.写出基态Zn原子的核外电子排布式
1s22s22p63s23p63d104s2或[Ar]3d104s2
1s22s22p63s23p63d104s2或[Ar]3d104s2
.(2)根据等电子原理,写出CO分子结构式
C≡O
C≡O
.(3)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀.
①甲醇的沸点比甲醛的高,其主要原因是
甲醇分子之间形成氢键
甲醇分子之间形成氢键
;甲醛分子中碳原子轨道的杂化类型为sp2杂化
sp2杂化
.②甲醛分子的空间构型是
平面三角形
平面三角形
;1mol甲醛分子中σ键的数目为3NA
3NA
.③在1个Cu2O晶胞中(结构如图1所示),所包含的Cu原子数目为
4
4
.(4)元素Cu的一种氯化物晶体的晶胞结构如图2所示,该氯化物的化学式是
CuCl
CuCl
,它可与浓盐酸发生非氧化还原反应,生成配合物HnCuCl3,反应的化学方程式为CuCl+2HCl=H2CuCl3
CuCl+2HCl=H2CuCl3
. [化学--选修物质结构]
[化学--选修物质结构]发展煤的液化技术被纳入“十二五”规划,中科院山西煤化所有关煤液化技术的高效催化剂研发项目近日已获批复.已知:煤可以先转化为一氧化碳和氢气,再在催化剂作用下合成甲醇,从而实现液化.
(1)根据等电子原理,写出CO分子的结构式
C≡O
C≡O
.(2)煤炭液化所用的一种催化剂含有铜元素,写出基态铜原子的核外电子排布简式
[Ar]3d104s1
[Ar]3d104s1
.(3)右图是铜的某种氧化物的晶胞结构示意图(顶角和体心是氧),可确定该氧化物的化学式为
Cu2O
Cu2O
.(4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子.已知NF3与NH3的结构类似,但NF3不易与Cu2+形成配离子,其主要原因是
NF3分子中氟原子电负性强,吸电子,使得氮原子上的孤对电子难于与Cu2+形成配位键
NF3分子中氟原子电负性强,吸电子,使得氮原子上的孤对电子难于与Cu2+形成配位键
.(5)煤液化获得甲醇,再经催化氧化可得到重要工业原料甲醛,甲醇的沸点比甲醛的高,其主要原因是
甲醇分子之间形成氢键
甲醇分子之间形成氢键
;甲醛分子中碳原子轨道的杂化类型为sp2杂化
sp2杂化
; 1mol甲醛分子中σ键的数目为3NA
3NA
.