题目内容
 (1)氧元素与多种元素具有亲和力,所形成化合物的种类很多.
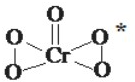
(1)氧元素与多种元素具有亲和力,所形成化合物的种类很多.①氧元素和过渡元素可形成多种价态的金属氧化物,如和铬可生成Cr2O3、CrO3、CrO5等.其中CrO5的结构式如图所示,请写出该物质中铬元素的化合价为
②氧元素可以和氢元素形成原子个数比为1:1的分子,该物质在酸性条件下与Fe2+发生反应的离子方程式为
③氧元素还可以形成多种离子,在NO2+中氮原子轨道杂化类型是
(2)请回答下列问题:
①解释CO2为直线形分子的原因
②为减少温室效应,科学家设计反应:CO2+4H2═CH4+2H2O以减小空气中CO2.若有1mol CH4生成,则有
③甲醇的沸点比甲醛的高,其主要原因是
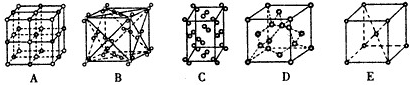
(3)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序).与冰的晶体结构相符的是
分析:(1)①根据过氧化铬的结构简式可知存在过氧键、Cr-O键、Cr=O来分析;
②氧元素可以和氢元素形成原子个数比为1:1的分子是过氧化氢,2Fe2++H2O2+2H+=2Fe3++2H2O;
③NO2+离子与CO2为等电子体,二者具有相同的结构;
(2)①中心原子碳是sp,两个杂化轨道分别被两碳氧σ键所占据;
②由反应方程式可知1mol CH4生成,消耗2mol的二氧化碳,则有2mol的π键断裂,中心原子价电子对数为
=3,所以杂化方式为sp2;
③甲醇和甲醛均由分子构成,分子间作用力决定两者的沸点的高点;
(3)冰属于分子晶体,利用晶胞图来判断晶体的构成微粒,以此来分析.
②氧元素可以和氢元素形成原子个数比为1:1的分子是过氧化氢,2Fe2++H2O2+2H+=2Fe3++2H2O;
③NO2+离子与CO2为等电子体,二者具有相同的结构;
(2)①中心原子碳是sp,两个杂化轨道分别被两碳氧σ键所占据;
②由反应方程式可知1mol CH4生成,消耗2mol的二氧化碳,则有2mol的π键断裂,中心原子价电子对数为
| 4-1+3 |
| 2 |
③甲醇和甲醛均由分子构成,分子间作用力决定两者的沸点的高点;
(3)冰属于分子晶体,利用晶胞图来判断晶体的构成微粒,以此来分析.
解答:解:(1)根据过氧化铬的结构简式可知一个铬与五个氧形成形成六个铬氧极性共价键,共用电子对偏向都偏向氧,所以呈+6,结构式中存在过氧键、Cr-O键、Cr=O,在4个Cr-O键中O为-1价,在Cr=O键注重O为-2价,故答案为:+6;-1;
②氧元素可以和氢元素形成原子个数比为1:1的分子是过氧化氢,过氧化氢是氧化剂,亚铁离子是还原剂,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
③CO2中C原子与氧原子之间形成C=O是,成2个σ键、不含孤对电子,碳原子采取sp杂化,NO2+离子与CO2为等电子体,具有相同的结构,故N原子也采取sp杂化,
故答案为:sp;
(2)①中心原子碳是sp,两个杂化轨道分别被两碳氧σ键所占据,分子立体构型为直线型,故答案为:中心原子碳的杂化方式为sp,键角为1800;
②由反应方程式可知1mol CH4生成,消耗2mol的二氧化碳,则有2mol的π键断裂,中心原子价电子对数为
=3,所以杂化方式为sp2,故答案为:2;平面三角形;
③甲醇分子间形成了氢键,而甲醛分子间为范德华力,导致甲醇分子间的作用力大于甲醛分子间的作用力,所以甲醇沸点高于甲醛,
故答案为:甲醇分子间形成了氢键,而甲醛分子间为范德华力,导致甲醇分子间的作用力大于甲醛分子间的作用力,所以甲醇沸点高于甲醛;
(3)冰属于分子晶体,由晶胞图可知,B为干冰的晶胞图,构成微粒为分子,C为碘的晶胞图,构成微粒为碘分子,则与冰的晶体类型相同的是BC,故答案为:BC.
②氧元素可以和氢元素形成原子个数比为1:1的分子是过氧化氢,过氧化氢是氧化剂,亚铁离子是还原剂,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
③CO2中C原子与氧原子之间形成C=O是,成2个σ键、不含孤对电子,碳原子采取sp杂化,NO2+离子与CO2为等电子体,具有相同的结构,故N原子也采取sp杂化,
故答案为:sp;
(2)①中心原子碳是sp,两个杂化轨道分别被两碳氧σ键所占据,分子立体构型为直线型,故答案为:中心原子碳的杂化方式为sp,键角为1800;
②由反应方程式可知1mol CH4生成,消耗2mol的二氧化碳,则有2mol的π键断裂,中心原子价电子对数为
| 4-1+3 |
| 2 |
③甲醇分子间形成了氢键,而甲醛分子间为范德华力,导致甲醇分子间的作用力大于甲醛分子间的作用力,所以甲醇沸点高于甲醛,
故答案为:甲醇分子间形成了氢键,而甲醛分子间为范德华力,导致甲醇分子间的作用力大于甲醛分子间的作用力,所以甲醇沸点高于甲醛;
(3)冰属于分子晶体,由晶胞图可知,B为干冰的晶胞图,构成微粒为分子,C为碘的晶胞图,构成微粒为碘分子,则与冰的晶体类型相同的是BC,故答案为:BC.
点评:本题考查元素周期表及元素周期律、化学键、化学反应方程式的书写、晶体类型与熔沸点高低判断等,学生注意利用信息和所学知识结合即可解答,难度不大.

练习册系列答案
相关题目
第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物。
(1)下列叙述正确的是?????? 。(填字母)
A.CH2O与水分子间能形成氢键
B.CH2O和CO2分子中的中心原子均采用sp2杂化
C.C6H6分子中含有6个 键和1个大
键和1个大 键,C6H6是非极性分子
键,C6H6是非极性分子
D.CO2晶体的熔点、沸点都比二氧化硅晶体的低
(2)Mn和Fe的部分电离能数据如下表:
元??? 素 | Mn | Fe | |
电离能 /kJ·mol-1 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 |
Mn元素价电子排布式为?????????? ,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是????????????????????????? 。
(3)根据元素原子的外围电子排布的特征,可将元素周期表分成五个区域,其中Ti属于 区。
(4)Ti的一种氧化物X,其晶胞结构如图所示,则X的化学式为???????????? 。

(5)电镀厂排放的废水中常含有剧毒的CN-离子,可在X的催化下,先用NaClO将CN-氧化成CNO-,再在酸性条件下CNO-继续被NaClO氧化成N2和CO2。
①H、C、N、O四种元素的电负性由小到大的顺序为??????????????????? 。
②与CNO-互为等电子体微粒的化学式为?????????? (写出一种即可)。
③氰酸(HOCN)是一种链状分子,它与异氰酸(HNCO)互为同分异构体,其分子内各原子最外层均已达到稳定结构,试写出氰酸的结构式?????? 。
 第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物.
第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物.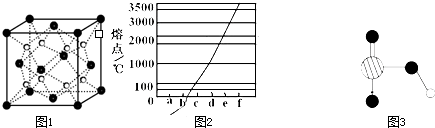
 ),请写出“502胶”发生黏合作用的化学方程式:_____________________________;反应类型是_____________。
),请写出“502胶”发生黏合作用的化学方程式:_____________________________;反应类型是_____________。 )也是一种黏合剂,工业上用丙烯酸和某物质在一定条件下反应可制得这种黏合剂,该物质的名称是_____________;请写出这一制取过程的化学方程式_________________。
)也是一种黏合剂,工业上用丙烯酸和某物质在一定条件下反应可制得这种黏合剂,该物质的名称是_____________;请写出这一制取过程的化学方程式_________________。 、
、 、
、 。已知含有
。已知含有