题目内容
 [化学--选修物质结构]
[化学--选修物质结构]发展煤的液化技术被纳入“十二五”规划,中科院山西煤化所有关煤液化技术的高效催化剂研发项目近日已获批复.已知:煤可以先转化为一氧化碳和氢气,再在催化剂作用下合成甲醇,从而实现液化.
(1)根据等电子原理,写出CO分子的结构式
C≡O
C≡O
.(2)煤炭液化所用的一种催化剂含有铜元素,写出基态铜原子的核外电子排布简式
[Ar]3d104s1
[Ar]3d104s1
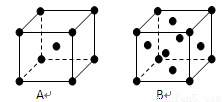
.(3)右图是铜的某种氧化物的晶胞结构示意图(顶角和体心是氧),可确定该氧化物的化学式为
Cu2O
Cu2O
.(4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子.已知NF3与NH3的结构类似,但NF3不易与Cu2+形成配离子,其主要原因是
NF3分子中氟原子电负性强,吸电子,使得氮原子上的孤对电子难于与Cu2+形成配位键
NF3分子中氟原子电负性强,吸电子,使得氮原子上的孤对电子难于与Cu2+形成配位键
.(5)煤液化获得甲醇,再经催化氧化可得到重要工业原料甲醛,甲醇的沸点比甲醛的高,其主要原因是
甲醇分子之间形成氢键
甲醇分子之间形成氢键
;甲醛分子中碳原子轨道的杂化类型为sp2杂化
sp2杂化
; 1mol甲醛分子中σ键的数目为3NA
3NA
.分析:(1)等电子体具有相似的结构和性质,根据N2的结构书写CO的结构式;
(2)铜的原子序数为29,根据能量最低原理以及鸿特规则书写基态原子的电子排布式;
(3)利用均摊法计算晶胞的化学式;
(4)从F原子的电负性的角度分析;
(5)甲醇存在氢键,沸点较高,甲醛(HCHO)中C原子形成3个δ键,以此判断杂化类型.
(2)铜的原子序数为29,根据能量最低原理以及鸿特规则书写基态原子的电子排布式;
(3)利用均摊法计算晶胞的化学式;
(4)从F原子的电负性的角度分析;
(5)甲醇存在氢键,沸点较高,甲醛(HCHO)中C原子形成3个δ键,以此判断杂化类型.
解答:解:(1)等电子体具有相似的结构和性质,NO与N2为等电子体,已知N2的结构为N≡N,则CO的结构式为C≡O,故答案为:C≡O;
(2)Cu的原子序数为29,位于周期表第四周期第ⅠB族,电子排布式为[Ar]3d104s1,故答案为:[Ar]3d104s1;
(3)已知顶点和体心为O,则晶胞中含有O的个数为8×
+1=2,Cu位于晶胞内部,则平均一个晶胞含有4个Cu,2个O,所以化学式为Cu2O,故答案为:Cu2O;
(4)F原子的电负性较强,氮原子上的孤对电子偏向F原子,而难以与Cu2+形成配位键,
故答案为:NF3分子中氟原子电负性强,吸电子,使得氮原子上的孤对电子难于与Cu2+形成配位键;
(5)甲醇存在氢键,沸点较高,甲醛(HCHO)中C原子形成3个δ键,碳原子轨道的杂化类型为sp2杂化,1mol甲醛分子中σ键的数目为3NA,
故答案为:甲醇分子之间形成氢键;sp2杂化;3NA.
(2)Cu的原子序数为29,位于周期表第四周期第ⅠB族,电子排布式为[Ar]3d104s1,故答案为:[Ar]3d104s1;
(3)已知顶点和体心为O,则晶胞中含有O的个数为8×
| 1 |
| 8 |
(4)F原子的电负性较强,氮原子上的孤对电子偏向F原子,而难以与Cu2+形成配位键,
故答案为:NF3分子中氟原子电负性强,吸电子,使得氮原子上的孤对电子难于与Cu2+形成配位键;
(5)甲醇存在氢键,沸点较高,甲醛(HCHO)中C原子形成3个δ键,碳原子轨道的杂化类型为sp2杂化,1mol甲醛分子中σ键的数目为3NA,
故答案为:甲醇分子之间形成氢键;sp2杂化;3NA.
点评:本题考查较为综合,涉及等电子体、电子排布式、晶胞的计算以及配位键等知识,题目难度中等,本题注意(4)为易错点.

练习册系列答案
相关题目