摘要: E2G.如图表示外界条件 的变化对下列反应的影响.在图中Y轴是指 ( ) A. F的转化率 B. E的物质的量 C. 平衡混合物中G的百分含量 D.平衡混合物中F的百分含量
网址:http://m.1010jiajiao.com/timu3_id_242372[举报]
如图表示配制100mL 0.100mol?L-1 Na2CO3溶液的几个关键实验步骤和操作,据图回答下列问题:

(1)若用Na2CO3?10H2O来配制溶液,需要称量晶体
(2)写出配制溶液中所需要用到的玻璃仪器的名称:烧杯、
(3)步骤B通常称为转移,步骤A通常称为
(4)将上述实验步骤A-F按实验过程先后次序排列
查看习题详情和答案>>

(1)若用Na2CO3?10H2O来配制溶液,需要称量晶体
2.9
2.9
克.若所取的晶体已经有一部分失去了结晶水,则所配制的溶液浓度偏大
大
.(填“大/小”).(2)写出配制溶液中所需要用到的玻璃仪器的名称:烧杯、
100mL容量瓶
100mL容量瓶
、玻璃棒、胶头滴管
玻璃棒、胶头滴管
.(3)步骤B通常称为转移,步骤A通常称为
定容
定容
,如果俯视刻度线,配制的浓度将偏大
大
(填大或小).步骤D称为洗涤
洗涤
,若没有步骤D,则配制的浓度偏小
小
.(填“大/小”).(4)将上述实验步骤A-F按实验过程先后次序排列
C、B、D、F、A、E
C、B、D、F、A、E
.
下列是A、B、C、D、E五中元素的某些性质:
(1)元素A是形成有机物的主要元素,下列分子中含有sp和sp3 杂化方式的是
A.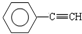 B.CH4 C.CH2=CHCH3D.CH3CH2C≡CH E.CH3CH3
B.CH4 C.CH2=CHCH3D.CH3CH2C≡CH E.CH3CH3
(2)用氢键表示式写出E的氢化物水溶液中存在的所有氢键 .
(3)相同条件下,AD2与BD2分子两者在水中的溶解度较大的是 (写分子式),理由是 ;
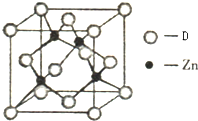
(4)如图表示某种元素D与锌形成的化合物晶胞,其中Zn和D通过共价键结合,该化合物的化学式为 ;该化合物的晶体熔点比干冰高得多,原因是 .
 查看习题详情和答案>>
查看习题详情和答案>>
| A | B | C | D | E | |
| 化合价 | -4 | -2 | -1 | -2 | -1 |
| 电负性 | 2.55 | 2.58 | 3.16 | 3.44 | 3.98 |
A.
 B.CH4 C.CH2=CHCH3D.CH3CH2C≡CH E.CH3CH3
B.CH4 C.CH2=CHCH3D.CH3CH2C≡CH E.CH3CH3(2)用氢键表示式写出E的氢化物水溶液中存在的所有氢键
(3)相同条件下,AD2与BD2分子两者在水中的溶解度较大的是
(4)如图表示某种元素D与锌形成的化合物晶胞,其中Zn和D通过共价键结合,该化合物的化学式为
 查看习题详情和答案>>
查看习题详情和答案>>
如图表示各物质之间的转化关系.已知D、E、Z是中学化学常见单质,其他都是化合物.Z、Y是氯碱工业的产品.D元素的原子最外层电子数与电子层数相等,且D的硫酸盐可作净水剂.E为日常生活中应用最广泛的金属.除反应①外,其他反应均在水溶液中进行.请回答下列问题:
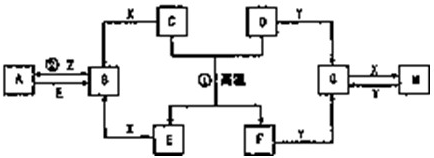
(1)标准状况下,11.2LH2在Z中完全燃烧生成气态X时,放出QkJ的热量,请写出相应的热化学反应方程式: .
(2)G的水溶液显 (填“酸性”、“碱性”或“中性”),其原因是 (用离子方程式表示)
(3)写出反应②的离子方程式: .
(4)写出D与Y的水溶液反应的离子方程式: ;若标准状况下有aL气体生成,则该反应转移电子的物质的量为 mol(用含a的代数式表示)
(5)在电镀工业中,若将E作为待镀金属,锌作为镀层金属,则E是 极,请写出此电极上发生的电极反应式: .
查看习题详情和答案>>

(1)标准状况下,11.2LH2在Z中完全燃烧生成气态X时,放出QkJ的热量,请写出相应的热化学反应方程式:
(2)G的水溶液显
(3)写出反应②的离子方程式:
(4)写出D与Y的水溶液反应的离子方程式:
(5)在电镀工业中,若将E作为待镀金属,锌作为镀层金属,则E是
 已知Ba(AlO2)2可溶于水.如图表示的是向含A12(SO4)30.01mol的溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系(其中a、c分别是0b段和bd段的中点).下列有关叙述正确的是( )
已知Ba(AlO2)2可溶于水.如图表示的是向含A12(SO4)30.01mol的溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加入Ba(OH)2的物质的量x的关系(其中a、c分别是0b段和bd段的中点).下列有关叙述正确的是( )
查看习题详情和答案>>
如图表示有关中学常见物质之间的相互转化关系(图中部分条件或产物已省略),其中B为黑色的非金属单质,D可使品红溶液褪色,E在通常状况下是无色无味液体,G是淡黄色的固体化合物,其中反应②可用于工业制玻璃.
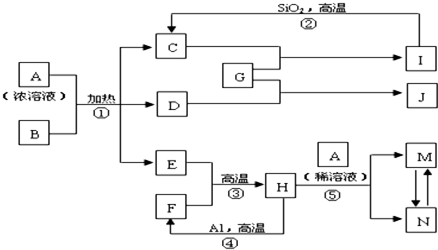
请回答下列问题:
(1)F的组成元素在周期表中的位置是
G的电子式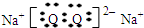
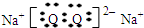 .
.
(2)写出上图中下列反应的化学方程式:
C+G→I:
A(浓)+B
:
E+F
:
(3)若1g Al参加④反应放出QkJ的热量,则该热化学方程式为:
(4)向图中反应⑤得到的M、N混合液中通入H2S气体,溶液变浑浊,酸性增强.请写出该过程发生反应的离子方程式
查看习题详情和答案>>

请回答下列问题:
(1)F的组成元素在周期表中的位置是
第四周期第Ⅷ族
第四周期第Ⅷ族
(指明周期和族),G的电子式
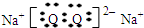
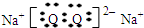
(2)写出上图中下列反应的化学方程式:
C+G→I:
2Na2O2+2CO2═2Na2CO3+O2↑
2Na2O2+2CO2═2Na2CO3+O2↑
A(浓)+B
| 加热 |
C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O
| ||
C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O
| ||
E+F
| 高温 |
3Fe+4H2O(g)
Fe3O4+4H2
| ||
3Fe+4H2O(g)
Fe3O4+4H2
| ||
(3)若1g Al参加④反应放出QkJ的热量,则该热化学方程式为:
8Al(S)+3Fe3O4(S)═9Fe(S)+4Al2O3(S) △H=-216QkJ/mol
8Al(S)+3Fe3O4(S)═9Fe(S)+4Al2O3(S) △H=-216QkJ/mol
.(4)向图中反应⑤得到的M、N混合液中通入H2S气体,溶液变浑浊,酸性增强.请写出该过程发生反应的离子方程式
2Fe3++H2S═2Fe2++S↓+2H+
2Fe3++H2S═2Fe2++S↓+2H+
.