题目内容
下列是A、B、C、D、E五中元素的某些性质:| A | B | C | D | E | |
| 化合价 | -4 | -2 | -1 | -2 | -1 |
| 电负性 | 2.55 | 2.58 | 3.16 | 3.44 | 3.98 |
A.
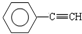 B.CH4 C.CH2=CHCH3D.CH3CH2C≡CH E.CH3CH3
B.CH4 C.CH2=CHCH3D.CH3CH2C≡CH E.CH3CH3(2)用氢键表示式写出E的氢化物水溶液中存在的所有氢键
(3)相同条件下,AD2与BD2分子两者在水中的溶解度较大的是
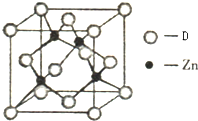
(4)如图表示某种元素D与锌形成的化合物晶胞,其中Zn和D通过共价键结合,该化合物的化学式为
分析:元素A是形成有机物的主要元素,且A元素能形成-4价,所以A是C元素,B和D能形成-2价,说明B、D位于第VIA族,且B的电负性小于D而大于A,B为S元素,D为O元素,C、E能形成-1价,说明C、E位于第VIIA族,C的电负性小于E,D的电负性小于E,则E为F元素,C为Cl元素,结合物质的结构、性质分析解答.
解答:解:元素A是形成有机物的主要元素,且A元素能形成-4价,所以A是C元素,B和D能形成-2价,说明B、D位于第VIA族,且B的电负性小于D而大于A,B为S元素,D为O元素,C、E能形成-1价,说明C、E位于第VIIA族,C的电负性小于E,D的电负性小于E,则E为F元素,C为Cl元素,
(1)分子中含有sp和sp3 杂化方式,说明分子中中心原子含有2个和4个价层电子对,
A. 中苯环上碳原子含有3个价层电子对,碳碳三键上碳原子含有2个价层电子对,所以该分子中的碳原子采用SP2、SP杂化,故A错误;
中苯环上碳原子含有3个价层电子对,碳碳三键上碳原子含有2个价层电子对,所以该分子中的碳原子采用SP2、SP杂化,故A错误;
B.CH4分子中碳原子含有4个价层电子对,为sp3 杂化,故B错误;
C.CH2=CHCH3分子中,碳碳双键两端的碳原子含有3个价层电子对,为SP2杂化,甲基上碳原子含有4个价层电子对,为sp3杂化,故C错误;
D.CH3CH2C≡CH分子中,碳碳三键两端的碳原子含有2个价层电子对,为SP杂化,甲基和亚甲基上碳原子含有4个价层电子对,为sp3杂化,故D正确;
E.CH3CH3分子中甲基上碳原子含有4个价层电子对,为sp3杂化,故E错误;
故选D;
(2)E的氢化物是氟化氢,氟化氢的水溶液中,氟化氢和氟化氢之间能形成氢键,水分子之间能形成氢键,水中氢离子和氟化氢中氟原子能形成氢键,氟化氢中氢原子和水中氧原子能形成氢键,所以其氢键有:F-H…F、F-H…O、O-H…F、O-H…O,
故答案为:F-H…F、F-H…O、O-H…F、O-H…O;
(3)AD2与BD2分别是二氧化碳和二氧化硫,二氧化碳是非极性分子,二氧化硫是极性分子,根据相似相溶原理知,二氧化碳不如二氧化硫易溶于水,故答案为:SO2;因为CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶”原理,SO2在H2O中的溶解度较大;
(4)D是O元素,根据均摊法知,该晶胞中,O原子个数=8×
+6×
=4,Zn原子个数=4,该晶胞中锌原子和氧原子个数之比为4:1=1:1,所以其化学式为ZnO,该晶胞中原子之间形成共价键,为原子晶体,干冰为分子晶体,原子晶体熔点较分子晶体高,所以该化合物的晶体熔点比干冰高得多,
故答案为:ZnO;ZnO是原子晶体,而干冰是分子晶体.
(1)分子中含有sp和sp3 杂化方式,说明分子中中心原子含有2个和4个价层电子对,
A.
 中苯环上碳原子含有3个价层电子对,碳碳三键上碳原子含有2个价层电子对,所以该分子中的碳原子采用SP2、SP杂化,故A错误;
中苯环上碳原子含有3个价层电子对,碳碳三键上碳原子含有2个价层电子对,所以该分子中的碳原子采用SP2、SP杂化,故A错误;B.CH4分子中碳原子含有4个价层电子对,为sp3 杂化,故B错误;
C.CH2=CHCH3分子中,碳碳双键两端的碳原子含有3个价层电子对,为SP2杂化,甲基上碳原子含有4个价层电子对,为sp3杂化,故C错误;
D.CH3CH2C≡CH分子中,碳碳三键两端的碳原子含有2个价层电子对,为SP杂化,甲基和亚甲基上碳原子含有4个价层电子对,为sp3杂化,故D正确;
E.CH3CH3分子中甲基上碳原子含有4个价层电子对,为sp3杂化,故E错误;
故选D;
(2)E的氢化物是氟化氢,氟化氢的水溶液中,氟化氢和氟化氢之间能形成氢键,水分子之间能形成氢键,水中氢离子和氟化氢中氟原子能形成氢键,氟化氢中氢原子和水中氧原子能形成氢键,所以其氢键有:F-H…F、F-H…O、O-H…F、O-H…O,
故答案为:F-H…F、F-H…O、O-H…F、O-H…O;
(3)AD2与BD2分别是二氧化碳和二氧化硫,二氧化碳是非极性分子,二氧化硫是极性分子,根据相似相溶原理知,二氧化碳不如二氧化硫易溶于水,故答案为:SO2;因为CO2是非极性分子,SO2和H2O都是极性分子,根据“相似相溶”原理,SO2在H2O中的溶解度较大;
(4)D是O元素,根据均摊法知,该晶胞中,O原子个数=8×
| 1 |
| 8 |
| 1 |
| 2 |
故答案为:ZnO;ZnO是原子晶体,而干冰是分子晶体.
点评:本题考查了化学式的确定、氢键、原子杂化方式的判断等知识点,这些都是考试热点,知道哪些物质之间能形成氢键、利用均摊法确定化学式、杂化方式的判断方法等即可解答,难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目




 B.CH4 C.CH2=CHCH3 D.CH3CH2C≡CH E.CH3CH3
B.CH4 C.CH2=CHCH3 D.CH3CH2C≡CH E.CH3CH3