题目内容
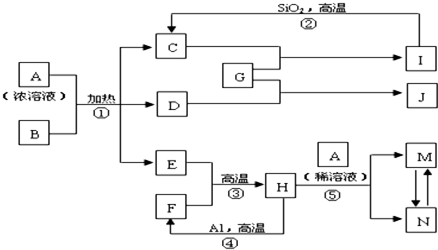
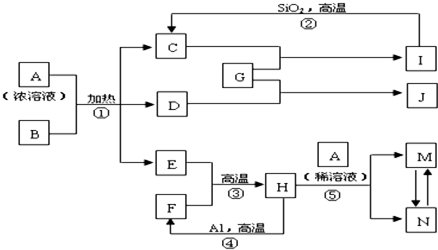
如图表示有关中学常见物质之间的相互转化关系(图中部分条件或产物已省略),其中B为黑色的非金属单质,D可使品红溶液褪色,E在通常状况下是无色无味液体,G是淡黄色的固体化合物,其中反应②可用于工业制玻璃.
请回答下列问题:
(1)F的组成元素在周期表中的位置是
G的电子式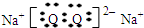
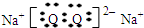 .
.
(2)写出上图中下列反应的化学方程式:
C+G→I:
A(浓)+B
:
E+F
:
(3)若1g Al参加④反应放出QkJ的热量,则该热化学方程式为:
(4)向图中反应⑤得到的M、N混合液中通入H2S气体,溶液变浑浊,酸性增强.请写出该过程发生反应的离子方程式

请回答下列问题:
(1)F的组成元素在周期表中的位置是
第四周期第Ⅷ族
第四周期第Ⅷ族
(指明周期和族),G的电子式
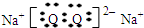
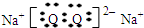
(2)写出上图中下列反应的化学方程式:
C+G→I:
2Na2O2+2CO2═2Na2CO3+O2↑
2Na2O2+2CO2═2Na2CO3+O2↑
A(浓)+B
| 加热 |
C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O
| ||
C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O
| ||
E+F
| 高温 |
3Fe+4H2O(g)
Fe3O4+4H2
| ||
3Fe+4H2O(g)
Fe3O4+4H2
| ||
(3)若1g Al参加④反应放出QkJ的热量,则该热化学方程式为:
8Al(S)+3Fe3O4(S)═9Fe(S)+4Al2O3(S) △H=-216QkJ/mol
8Al(S)+3Fe3O4(S)═9Fe(S)+4Al2O3(S) △H=-216QkJ/mol
.(4)向图中反应⑤得到的M、N混合液中通入H2S气体,溶液变浑浊,酸性增强.请写出该过程发生反应的离子方程式
2Fe3++H2S═2Fe2++S↓+2H+
2Fe3++H2S═2Fe2++S↓+2H+
.分析:B为黑色的非金属单质,应为C,D可使品红溶液褪色,应为SO2,则A为H2SO4,E在通常状况下是无色无味液体,应为H2O,则C为CO2,G是淡黄色的固体化合物,应为Na2O2,则I为Na2CO3,反应②可用于工业制玻璃,J为Na2SO4,反应④为铝热反应,F为Fe,H为Fe3O4,与稀硫酸反应生成硫酸铁和硫酸亚铁,结合对应单质、化合物的性质解答该题.
解答:解:B为黑色的非金属单质,应为C,D可使品红溶液褪色,应为SO2,则A为H2SO4,E在通常状况下是无色无味液体,应为H2O,则C为CO2,G是淡黄色的固体化合物,应为Na2O2,则I为Na2CO3,反应②可用于工业制玻璃,J为Na2SO4,反应④为铝热反应,F为Fe,H为Fe3O4,与稀硫酸反应生成硫酸铁和硫酸亚铁,
(1)由以上分析可知F为Fe,位于周期表第四周期第Ⅷ族,G为Na2O2,电子式为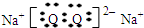 ,
,
故答案为:第四周期第Ⅷ族;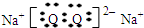 ;
;
(2)根据题意可知,Na2O2与CO2反应生成Na2CO3和O2,反应的方程式为2Na2O2+2CO2═2Na2CO3+O2↑,
C和浓硫酸在加热条件下发生氧化还原反应,反应的方程式为C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O,
Fe和水蒸气在高温下反应生成Fe3O4和H2,反应的方程式为3Fe+4H2O(g)
Fe3O4+4H2,
故答案为:2Na2O2+2CO2═2Na2CO3+O2↑;C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O;3Fe+4H2O(g)
Fe3O4+4H2;
(3)反应④为铝热反应,n(Al)=
mol,则8molAl反应放出的热量为216QkJ能量,
反应的热化学方程式为8Al(S)+3Fe3O4(S)═9Fe(S)+4Al2O3(S) △H=-216Q kJ/mol,
故答案为:8Al(S)+3Fe3O4(S)═9Fe(S)+4Al2O3(S) △H=-216Q kJ/mol;
(4)M、N混合液中含有Fe3+,具有强氧化性,可与H2S发生氧化还原反应,
反应的离子方程式为2Fe3++H2S═2Fe2++S↓+2H+,
故答案为:2Fe3++H2S═2Fe2++S↓+2H+.
(1)由以上分析可知F为Fe,位于周期表第四周期第Ⅷ族,G为Na2O2,电子式为
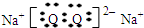 ,
,故答案为:第四周期第Ⅷ族;
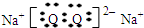 ;
;(2)根据题意可知,Na2O2与CO2反应生成Na2CO3和O2,反应的方程式为2Na2O2+2CO2═2Na2CO3+O2↑,
C和浓硫酸在加热条件下发生氧化还原反应,反应的方程式为C+2H2SO4(浓)
| ||
Fe和水蒸气在高温下反应生成Fe3O4和H2,反应的方程式为3Fe+4H2O(g)
| ||
故答案为:2Na2O2+2CO2═2Na2CO3+O2↑;C+2H2SO4(浓)
| ||
| ||
(3)反应④为铝热反应,n(Al)=
| 1 |
| 27 |
反应的热化学方程式为8Al(S)+3Fe3O4(S)═9Fe(S)+4Al2O3(S) △H=-216Q kJ/mol,
故答案为:8Al(S)+3Fe3O4(S)═9Fe(S)+4Al2O3(S) △H=-216Q kJ/mol;
(4)M、N混合液中含有Fe3+,具有强氧化性,可与H2S发生氧化还原反应,
反应的离子方程式为2Fe3++H2S═2Fe2++S↓+2H+,
故答案为:2Fe3++H2S═2Fe2++S↓+2H+.
点评:本题考查无机物的推断,题目难度中等,本题注意把握题给信息,结合物质的特性进行推断,为正确推断物质的种类为解答该题的关键,注意相关反应的化学方程式的书写,为易错点,注意体会.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 (2009?合肥三模)A、B、C、D、E是中学常见的单质,X是化合物.A为金属,原子最外层p轨道上只有一个电子,可与NaOH溶液反应;B是常见的金属,其基态原子的外围电子排布式为3d64s2;常温下C是气态非金属单质,可以燃烧;D是空气主要成分之一,可与C发生重要工业反应生成X;E是固体非金属单质,在氧气中燃烧时有明亮的蓝紫色火焰.根据上述物质的信息,回答下列有关问题:
(2009?合肥三模)A、B、C、D、E是中学常见的单质,X是化合物.A为金属,原子最外层p轨道上只有一个电子,可与NaOH溶液反应;B是常见的金属,其基态原子的外围电子排布式为3d64s2;常温下C是气态非金属单质,可以燃烧;D是空气主要成分之一,可与C发生重要工业反应生成X;E是固体非金属单质,在氧气中燃烧时有明亮的蓝紫色火焰.根据上述物质的信息,回答下列有关问题: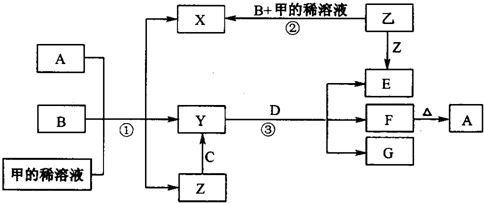
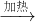 :______
:______ :______
:______
 :______ CO2↑+2SO2↑+2H2O
:______ CO2↑+2SO2↑+2H2O