题目内容
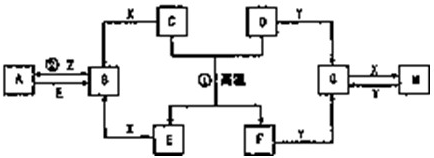
如图表示各物质之间的转化关系.已知D、E、Z是中学化学常见单质,其他都是化合物.Z、Y是氯碱工业的产品.D元素的原子最外层电子数与电子层数相等,且D的硫酸盐可作净水剂.E为日常生活中应用最广泛的金属.除反应①外,其他反应均在水溶液中进行.请回答下列问题:
(1)标准状况下,11.2LH2在Z中完全燃烧生成气态X时,放出QkJ的热量,请写出相应的热化学反应方程式: .
(2)G的水溶液显 (填“酸性”、“碱性”或“中性”),其原因是 (用离子方程式表示)
(3)写出反应②的离子方程式: .
(4)写出D与Y的水溶液反应的离子方程式: ;若标准状况下有aL气体生成,则该反应转移电子的物质的量为 mol(用含a的代数式表示)
(5)在电镀工业中,若将E作为待镀金属,锌作为镀层金属,则E是 极,请写出此电极上发生的电极反应式: .

(1)标准状况下,11.2LH2在Z中完全燃烧生成气态X时,放出QkJ的热量,请写出相应的热化学反应方程式:
(2)G的水溶液显
(3)写出反应②的离子方程式:
(4)写出D与Y的水溶液反应的离子方程式:
(5)在电镀工业中,若将E作为待镀金属,锌作为镀层金属,则E是
分析:图中D、E、Z是单质,其余均是化合物.且知E为日常常用金属;D元素的原子最外层电子数与电子层数相等,C+D=E+F是置换反应,推断高温下为铝热反应,推断D为Al,E为Fe,F为Al2O3;Z、Y是氯碱工业的产品,依据Al、Al2O3和Y反应推断,Y为NaOH;得到Z为Cl2,X为HCl,反应均在水溶液中进行,所以推断得到G为NaAlO2,M为AlCl3;B为FeCl2,A为FeCl3;
解答:解:图中D、E、Z是单质,其余均是化合物.且知E为日常常用金属;D元素的原子最外层电子数与电子层数相等,C+D=E+F是置换反应,推断高温下为铝热反应,推断D为Al,E为Fe,F为Al2O3;Z、Y是氯碱工业的产品,依据Al、Al2O3和Y反应推断,Y为NaOH;得到Z为Cl2,X为HCl,反应均在水溶液中进行,所以推断得到G为NaAlO2,M为AlCl3;B为FeCl2,A为FeCl3;
(1)标准状况下,11.2LH2在Z为氯气中完全燃烧生成气态X为氯化氢时,放出QkJ的热量,热化学方程式为:H2(g)+Cl2(g)=2HCl(g)△H=-2QKJ/mol;
故答案为:H2(g)+Cl2(g)=2HCl(g)△H=-2QKJ/mol;
(2)G为NaAlO2 水溶液中偏铝酸根离子水解结合氢离子生成氢氧化铝和氢氧根离子,溶液呈碱性,反应的离子方程式为:AlO2-+2H2O?Al(OH)3+OH-;
故答案为:碱性,AlO2-+2H2O?Al(OH)3+OH-;
(3)反应②是氯气和亚铁离子反应生成铁离子的反应,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-;
故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(4)D为Al与Y为 NaOH的水溶液,反应生成偏铝酸钠和氢气,反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑;生成3mol氢气转移电子为6mol电子,若标准状况下有aL气体氢气生成,则该反应转移电子的物质的量为
×2=
mol;
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
;
(5)在电镀工业中,若将E作为待镀金属,锌作为镀层金属,则E待镀金属做阴极,镀层金属做阳极,阴极发生的电极反应为:Zn2++2e-=Zn;
故答案为:阴,Zn2++2e-=Zn;
(1)标准状况下,11.2LH2在Z为氯气中完全燃烧生成气态X为氯化氢时,放出QkJ的热量,热化学方程式为:H2(g)+Cl2(g)=2HCl(g)△H=-2QKJ/mol;
故答案为:H2(g)+Cl2(g)=2HCl(g)△H=-2QKJ/mol;
(2)G为NaAlO2 水溶液中偏铝酸根离子水解结合氢离子生成氢氧化铝和氢氧根离子,溶液呈碱性,反应的离子方程式为:AlO2-+2H2O?Al(OH)3+OH-;
故答案为:碱性,AlO2-+2H2O?Al(OH)3+OH-;
(3)反应②是氯气和亚铁离子反应生成铁离子的反应,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-;
故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(4)D为Al与Y为 NaOH的水溶液,反应生成偏铝酸钠和氢气,反应的离子方程式:2Al+2OH-+2H2O=2AlO2-+3H2↑;生成3mol氢气转移电子为6mol电子,若标准状况下有aL气体氢气生成,则该反应转移电子的物质的量为
| aL |
| 22.4L/mol |
| a |
| 11.2 |
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
| a |
| 11.2 |
(5)在电镀工业中,若将E作为待镀金属,锌作为镀层金属,则E待镀金属做阴极,镀层金属做阳极,阴极发生的电极反应为:Zn2++2e-=Zn;
故答案为:阴,Zn2++2e-=Zn;
点评:本题考查了无机框图转化关系的分析判断,物质性质的分析应用,反应条件和反应特征和转化关系理解是解题关键,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目


 ]2-Na+
]2-Na+
