网址:http://m.1010jiajiao.com/timu3_id_198285[举报]
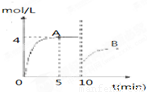
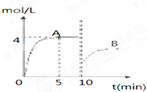 在一定条件下,合成塔中氮气和氢气的起始浓度分别为a mol?L-1和b mol?L-1,反应为:N2+3H2?2NH3,氨气的浓度随时间变化如图所示.
在一定条件下,合成塔中氮气和氢气的起始浓度分别为a mol?L-1和b mol?L-1,反应为:N2+3H2?2NH3,氨气的浓度随时间变化如图所示.(1)反应到5min时,氢气反应速率
| 16 |
| (a-2)×(b-4)3 |
| 16 |
| (a-2)×(b-4)3 |
(2)在10min时采取的措施是
(3)-50°C时,液氨存在如下电离:2NH3?NH4++NH-2,K=2×10-12,往液氨中加入NH4Cl固体,K
(4)已知2A2(g)+B2(g)═2C3(g);△H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C3的浓度为w mol/L,放出热量b kJ.若在原来的容器中,只加入2mol C3,500℃时充分反应达平衡后,吸收热量c kJ,a、b、c之间满足何种关系
(1)反应到5min时,氢气反应速率 .A的平衡常数为 (用含a,b的表达式表示)
(2)在10min时采取的措施是 ;
(3)-50°C时,液氨存在如下电离:2NH3?NH4++NH-2,K=2×10-12,往液氨中加入NH4Cl固体,K 2×10-12(填“<”、“>”或“=”)
(4)已知2A2(g)+B2(g)═2C3(g);△H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C3的浓度为w mol/L,放出热量b kJ.若在原来的容器中,只加入2mol C3,500℃时充分反应达平衡后,吸收热量c kJ,a、b、c之间满足何种关系 (用代数式表示)
 查看习题详情和答案>>
查看习题详情和答案>>
(14分)
含硫化合物在工业生产中有广泛的用途。
(1)对于可逆反应2SO2(g)+O2(g)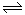 2SO3(g) △H<0,下列研究目的和图示相符的是
2SO3(g) △H<0,下列研究目的和图示相符的是
(填序号)
| 序号 | A | B | C | D |
| 目的 | 压强对平衡的影响 | 温度对转化率的影响 | 增加O2浓度对速率的影响 | 浓度对平衡常数的影响 |
| 图示 | 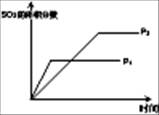 |  | 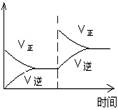 | 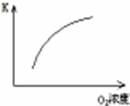 |
乙。(填“>”“<”或“="”" )
(3)向2L的甲容器中充入2molSO2、1molO2,测得SO2的平衡转化率与温度的关系如下图所示。
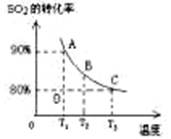
Ⅰ.在T1温度下,反应进行到状态D时,v正 v逆。(填“>”“<”或“="”" )
Ⅱ.T3温度下,平衡时测得反应放出的热量为Q1,在相同温度下若再向容器中通入2molSO2、1molO2,重新达到平衡,测得反应又放出热量Q2 。则下列说法中正确的是 。(填序号)
A.相同温度下新平衡时容器中的压强是原平衡时的两倍
B.Q2一定大于Q1
C.新平衡时SO2的转化率一定大于80%
(4)在甲容器中充入一定量的SO2和1.100molO2,在催化剂作用下加热,当气体的物质的量减少0.315mol时反应达到平衡,此时测得气体压强为反应前的82.5%,则SO2的转化率为 。
(5)若用氢氧化钠溶液吸收SO2气体恰好得到酸式盐,已知该酸式盐溶液呈弱酸性,则溶液中各离子浓度由大到小的顺序为 。(用离子浓度符号表示)
(6)一定温度下,用水吸收SO2气体,若得到pH=5的H2SO3溶液,则溶液中亚硫酸氢根离子和亚硫酸根离子的物质的量浓度之比为 。(已知该温度下H2SO3的电离常数:Ka1=1.0×10-2mol/L,Ka2=6.0×10-3mol/L) 查看习题详情和答案>>
含硫化合物在工业生产中有广泛的用途。
(1)对于可逆反应2SO2(g)+O2(g)
 2SO3(g) △H<0,下列研究目的和图示相符的是
2SO3(g) △H<0,下列研究目的和图示相符的是 (填序号)
| 序号 | A | B | C | D |
| 目的 | 压强对平衡的影响 | 温度对转化率的影响 | 增加O2浓度对速率的影响 | 浓度对平衡常数的影响 |
| 图示 | 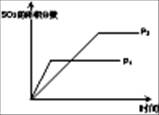 |  | 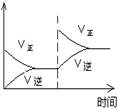 | 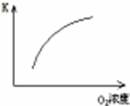 |
乙。(填“>”“<”或“="”" )
(3)向2L的甲容器中充入2molSO2、1molO2,测得SO2的平衡转化率与温度的关系如下图所示。
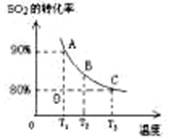
Ⅰ.在T1温度下,反应进行到状态D时,v正 v逆。(填“>”“<”或“="”" )
Ⅱ.T3温度下,平衡时测得反应放出的热量为Q1,在相同温度下若再向容器中通入2molSO2、1molO2,重新达到平衡,测得反应又放出热量Q2 。则下列说法中正确的是 。(填序号)
A.相同温度下新平衡时容器中的压强是原平衡时的两倍
B.Q2一定大于Q1
C.新平衡时SO2的转化率一定大于80%
(4)在甲容器中充入一定量的SO2和1.100molO2,在催化剂作用下加热,当气体的物质的量减少0.315mol时反应达到平衡,此时测得气体压强为反应前的82.5%,则SO2的转化率为 。
(5)若用氢氧化钠溶液吸收SO2气体恰好得到酸式盐,已知该酸式盐溶液呈弱酸性,则溶液中各离子浓度由大到小的顺序为 。(用离子浓度符号表示)
(6)一定温度下,用水吸收SO2气体,若得到pH=5的H2SO3溶液,则溶液中亚硫酸氢根离子和亚硫酸根离子的物质的量浓度之比为 。(已知该温度下H2SO3的电离常数:Ka1=1.0×10-2mol/L,Ka2=6.0×10-3mol/L)
(13分) 无水氯化镁是制备某种催化剂的中间体。某研究性学习小组设计实验方案进行制取无水氯化镁等实验。请填写下列空白。
[实验一]利用下图实验装置(夹持和加热装置省略),在HCl气流中小心加热MgCl2·6H2O晶体制取无水氯化镁(无水氯化镁易吸水)。烧瓶中发生的反应为:
NaCl+H2SO4(浓)===NaHSO4+HCl↑
(1)试剂X是 。第二个洗气瓶中的浓硫酸的作用是
(2)该实验装置存在一个缺陷是 。
[实验二]通过下列步骤,测定实验一所得产物中氯元素含量以确定产物是否含有结晶水:
①称取m1g样品置于烧杯中,充分溶解;
②加入足量硝酸银溶液,充分反应后,过滤;
③洗涤沉淀,干燥至恒重,称得沉淀质量为m2g。
(3)若步骤③的操作中未洗涤沉淀,将导致测得的氯元素含量 (填“偏高”或“偏低”)
(4)若测得m1=10.40,m2=28.70,则所得产品MgCl2·nH2O中n的值为 。
[实验三]一定条件下,氯化镁与四氯化钛的混合物可作烯烃聚合反应的催化剂。为了探究温度、氯化镁固体的含水量以及粉碎方式对该催化剂催化效果的影响,设计如下对比实验:
| 实验序号 | 氯化镁固体中氯元素含量/% | 温度/℃ | 粉碎方式 | 催化效果/g·g-1 |
| 1 | 70.97 | 20 | 滚动球磨 | 3.9×104 |
| 2 | 74.45 | 20 | 滚动球磨 | 5.0×104 |
| 3 | 74.45 | 20 | 振动球磨 | 5.9×104 |
| 4 | ω | 100 | 振动球磨 |
|
注:催化效果用单位时间内每克催化剂得到产品的质量来表示
(5)表中ω= 。
(6)从实验1、2可以得出的结论是 。
(7)设计实验2、3的目的是 。
查看习题详情和答案>>