��Ŀ����
(14��)
�������ڹ�ҵ�������й㷺����;��
��1�����ڿ��淴Ӧ2SO2(g)��O2(g)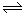 2SO3(g) ��H��0�������о�Ŀ�ĺ�ͼʾ�������
2SO3(g) ��H��0�������о�Ŀ�ĺ�ͼʾ�������
������ţ�
| ��� | A | B | C | D |
| Ŀ�� | ѹǿ��ƽ���Ӱ�� | �¶ȶ�ת���ʵ�Ӱ�� | ����O2Ũ�ȶ����ʵ�Ӱ�� | Ũ�ȶ�ƽ�ⳣ����Ӱ�� |
| ͼʾ |  |  | 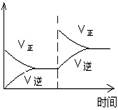 | 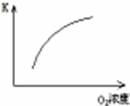 |
�ҡ����>����<����="��" ��
��3����2L�ļ������г���2molSO2��1molO2�����SO2��ƽ��ת�������¶ȵĹ�ϵ����ͼ��ʾ��
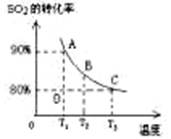
��.��T1�¶��£���Ӧ���е�״̬Dʱ��v�� v�������>����<����="��" ��
��.T3�¶��£�ƽ��ʱ��÷�Ӧ�ų�������ΪQ1������ͬ�¶���������������ͨ��2molSO2��1molO2�����´ﵽƽ�⣬��÷�Ӧ�ַų�����Q2 ��������˵������ȷ���� ��������ţ�
A����ͬ�¶�����ƽ��ʱ�����е�ѹǿ��ԭƽ��ʱ������
B��Q2һ������Q1
C����ƽ��ʱSO2��ת����һ������80%
��
��4���ڼ������г���һ������SO2��1.100molO2���ڴ��������¼��ȣ�����������ʵ�������0.315molʱ��Ӧ�ﵽƽ�⣬��ʱ�������ѹǿΪ��Ӧǰ��82.5%����SO2��ת����Ϊ ��
����5����������������Һ����SO2����ǡ�õõ���ʽ�Σ���֪����ʽ����Һ�������ԣ�����Һ�и�����Ũ���ɴ�С��˳��Ϊ ����������Ũ�ȷ��ű�ʾ��
����6��һ���¶��£���ˮ����SO2���壬���õ�pH=5��H2SO3��Һ������Һ��������������Ӻ�����������ӵ����ʵ���Ũ��֮��Ϊ ���� ������֪���¶���H2SO3�ĵ��볣����Ka1=1.0��10-2mol/L��Ka2=6.0��10-3mol/L��
(ÿ��2�֣���14��)
��1�� C ���д���0�֣�
(2) <
(3) I > II B C����һ����1�֣��д���0�֣�
(4) 90%
(5) c (Na+) ��c (HSO3��) ��c (H+)��c (SO32��)��c (OH��) �����0�� ��
��6��1/6 ��10-2 ��1.67 ��10-3
���������������1��A����ͼ��֪��P1>P2��ѹǿ����ƽ�������ƶ�������������������Ӧ������ͼ����������B���÷�ӦΪ���ȷ�Ӧ���¶����ߣ�ƽ�������ƶ������������ת���ʽ��ͣ���ͼ����������C������������Ũ�ȣ�����Ӧ���������淴Ӧ���ʲ��䣬ƽ�������ƶ�����ͼ���ϣ���ȷ��D������Ũ�������¶Ȳ��䣬ƽ�ⳣ�����䣬��ͼ����������ѡC��
��2����ʼʱ�ס�����������ѹǿ��ͬ����ƽ��ʱ����������ѹǿС���ң����Լ�����������ѹǿ���ܴﵽ��������ѹǿ��������ѹǿ��ƽ�������ƶ���������������������������SO3�����������<�ң�
��3��I��T1�¶�ʱA��������¶ȵĶ�������ƽ��ת���ʣ�D��Ķ��������ת���ʵ���A�㣬˵����Ӧδ��ƽ�⣬����v��>v����
II�����º���ʱ�����������ͨ��2molSO2��1molO2����Ӧ��Ũ����ԭ����2������ԭƽ��Ļ����ϣ�ƽ�������ƶ�������������ѹǿ��С�ķ������Դ���ƽ��ʱѹǿ����ԭƽ��ʱ��ѹǿ��С������ԭƽ���ѹǿ���ų���������Q1�࣬���������ת������ߣ����Դ�ѡBC��
��4������������������ʵ���Ϊamol��ÿ����2mol ������������������ʵ�������1mol��������������ʵ�������0.315mol��˵�����Ķ�������0.63mol����������0.315mol��������������0.63mol�����ݺ�����ѹǿ֮�ȵ����������ʵ���֮�ȣ���(a-0.63+0.63+1.1-0.315)/(a+1.1)=82.5%,���a=0.7,����SO2��ת����Ϊ0.63mol/0.7mol��100%=90%��
��5�������������������Ʒ�Ӧ����ʽ��Ϊ���������ƣ���Һ�����ԣ�˵��HSO3���ĵ���̶ȴ���ˮ��̶ȣ���Һ������Ũ�ȵĴ�С˳��Ϊ c (Na+) ��c (HSO3��) ��c (H+)��c (SO32��)��c (OH��)
��6����Һ�е�c (H+)=1��10-5mol/L��ƽ��ʱKa2=6.0��10-3mol/L=c (SO32��)c (H+)/c (HSO3��),����c (HSO3��)/c (SO32��)="c" (H+)/Ka2=1/6 ��10-2��
���㣺���黯ѧƽ����ͼ��Ķ�Ӧ��ϵ��ƽ����ƶ�������Ũ�ȵıȽϣ�ƽ�ⳣ����Ӧ��

��16�֣�Ӱ�컯ѧ��Ӧ���ʵ����غܶ࣬ijУ��ѧС����ʵ��ķ�������̽����
ʵ��һ������ֻ����Cu��Fe��Mg�Ͳ�ͬŨ�ȵ�����(0.5 mol��L��1��2 mol��L��1��18.4 mol��L��1)���ʵ�鷽�����о�Ӱ�췴Ӧ���ʵ����ء���ͬѧ��ʵ�鱨�����±���
| ʵ�鲽�� | ���� | ���� |
| �ٷֱ�ȡ�������2 mol��L��1���������Թ��� | ��Ӧ����Mg>Fe��Cu����Ӧ | ����������Խ���ã���Ӧ����Խ�� |
| ��____________ | | ��Ӧ��Ũ��Խ��Ӧ����Խ�� |
��2����ͬѧ��ʵ��Ŀ����_____________��Ҫ�ó���ȷ��ʵ����ۣ�������Ƶ�ʵ��������____________����ͬѧΪ�˸���ȷ���о�Ũ�ȶԷ�Ӧ���ʵ�Ӱ�죬������ͼ��ʾװ�ý��ж���ʵ�顣
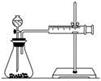
��3����ͬѧ��ʵ����Ӧ�òⶨ��������___________________________________________________��
��4����ͬѧ��ɸ�ʵ��Ӧѡ�õ�ʵ��ҩƷ��________����ʵ���в�ѡ��ijŨ�ȵ����ᣬ������___________��
ʵ�������֪ 2KMnO4��5H2C2O4��3H2SO4===K2SO4��2MnSO4��8H2O��10CO2�����ڸ������������Һ�Ͳ�����Һ��Ӧʱ�����ֿ�ʼһ��ʱ�䣬��Ӧ���ʽ�������Һ��ɫ�����ԣ�������ͻȻ��ɫ����Ӧ�������Լӿ졣
��5���������ʵ������ͬѧ��ΪKMnO4��H2C2O4��Ӧ���ȣ�������Һ�¶����ߣ���Ӧ���ʼӿ졣��Ӱ�컯ѧ��Ӧ���ʵ����ؿ�������뻹������______________��Ӱ�졣
��6������ʵ��֤����IJ��룬���������������Һ��������Һ�⣬����Ҫѡ����Լ����������________(����ĸ)��
A������ء�������������B�������� C�����Ȼ��� D��ˮ
(9��)��֪A(g)+B(g)  C(g)+D(g)��Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵ���£�
C(g)+D(g)��Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵ���£�
| |�¶�/ �� | 700 | 900 | 830 | 1000 | 1200 |
| ƽ�ⳣ�� | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
(1)�÷�Ӧ��ƽ�ⳣ������ʽK= ����H 0���<���� >���� =��)��
(2)830��ʱ����һ��5 L���ܱ������г���0.20mol��A��0.80mol��B���練Ӧ��ʼ6s��A��ƽ����Ӧ����v(A)=0��003 mol��L-1��s-1����6sʱc(A)= mol��L-1�� C�����ʵ���Ϊ mol������Ӧ��һ��ʱ��ﵽƽ��ʱA��ת����Ϊ �������ʱ����ܱ��������ٳ���1 mol�����ƽ��ʱA��ת����Ϊ ��
(3)�жϸ÷�Ӧ�Ƿ�ﵽƽ�������Ϊ (����ȷѡ��ǰ����ĸ)��
a��ѹǿ����ʱ��ı� b��������ܶȲ���ʱ��ı�
c��c(A)����ʱ��ı� d����λʱ��������C��D�����ʵ������
(4)1200��ʱ��ӦC(g)+D(g)
 A(g)+B(g)��ƽ�ⳣ����ֵΪ ��
A(g)+B(g)��ƽ�ⳣ����ֵΪ �� һ���¶��£���һ��10 L�ܱ������з���ij���淴Ӧ����ƽ�ⳣ������ʽΪK��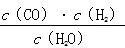 ����ش��������⡣
����ش��������⡣
(1)�÷�Ӧ�Ļ�ѧ����ʽΪ__________________________________________��
���¶����ߣ�K������÷�Ӧ��________��Ӧ(����ȡ����ȡ�)��
(2)���жϸ÷�Ӧһ���ﵽƽ��״̬����________(����ĸ���)��
| A��v��(H2O)��v��(H2) |
| B�������������ƽ����Է�����������ʱ��ı� |
| C������n mol H2��ͬʱ����n mol CO |
| D�����������ʵ������ʵ�������ʱ��ı� |

(4)ʵ����t2ʱ����������1 mol H2O(g)��5 min��H2O(g)�����ʵ�����0.8 mol����5 min��H2O(g)��ƽ����Ӧ����Ϊ________��
 2C(g) ,�ڷ�Ӧ�����У�C�����ʵ���n(C)��ʱ��ı仯��ϵ����ͼ��ʾ����t1ʱ�俪ʼ�Է�Ӧ��ϵ�����¶ȣ����Իش��������⣺
2C(g) ,�ڷ�Ӧ�����У�C�����ʵ���n(C)��ʱ��ı仯��ϵ����ͼ��ʾ����t1ʱ�俪ʼ�Է�Ӧ��ϵ�����¶ȣ����Իش��������⣺
 CH3OH��g����H1����116 kJ��mol��1
CH3OH��g����H1����116 kJ��mol��1 ��H2����283 kJ��mol��1
��H2����283 kJ��mol��1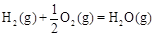 ��H3����242 kJ��mol��1
��H3����242 kJ��mol��1


 Ph��CH��CH2(g)+H2(g) ��H
Ph��CH��CH2(g)+H2(g) ��H

 CH3OCH3��g��+3H2O��g�� ��H=-122��4kJ��mol��1
CH3OCH3��g��+3H2O��g�� ��H=-122��4kJ��mol��1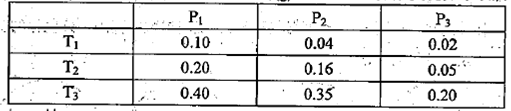
 ����������䡱��С��������̼�����Һ���տ�����CO2�����ܶɳ�����ʱ�����й�ϵ��˵����ȷ���� ��
����������䡱��С��������̼�����Һ���տ�����CO2�����ܶɳ�����ʱ�����й�ϵ��˵����ȷ���� �� ��+c��HCO
��+c��HCO ��+c��H2CO3��
��+c��H2CO3�� c��CO
c��CO