��Ŀ����
(14��)
�������ڹ�ҵ�������й㷺����;��
��1�����ڿ��淴Ӧ2SO2(g)��O2(g)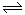 2SO3(g) ��H��0�������о�Ŀ�ĺ�ͼʾ�������
2SO3(g) ��H��0�������о�Ŀ�ĺ�ͼʾ�������
������ţ�
��2����5000C�д������ڵ������£����ݻ�Ϊ2L�ļ��������ܱ������о�����2molSO2��1molO2���ױ����ݻ����䣬�ұ���ѹǿ���䣬��ַ�Ӧ����ƽ��״̬����ʱSO3�����������
�ҡ����>����<����="��" ��
��3����2L�ļ������г���2molSO2��1molO2�����SO2��ƽ��ת�������¶ȵĹ�ϵ����ͼ��ʾ��
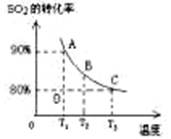
��.��T1�¶��£���Ӧ���е�״̬Dʱ��v�� v�������>����<����="��" ��
��.T3�¶��£�ƽ��ʱ��÷�Ӧ�ų�������ΪQ1������ͬ�¶���������������ͨ��2molSO2��1molO2�����´ﵽƽ�⣬��÷�Ӧ�ַų�����Q2 ��������˵������ȷ���� ��������ţ�
A����ͬ�¶�����ƽ��ʱ�����е�ѹǿ��ԭƽ��ʱ������
B��Q2һ������Q1
C����ƽ��ʱSO2��ת����һ������80%
��
��4���ڼ������г���һ������SO2��1.100molO2���ڴ��������¼��ȣ�����������ʵ�������0.315molʱ��Ӧ�ﵽƽ�⣬��ʱ�������ѹǿΪ��Ӧǰ��82.5%����SO2��ת����Ϊ ��
����5����������������Һ����SO2����ǡ�õõ���ʽ�Σ���֪����ʽ����Һ�������ԣ�����Һ�и�����Ũ���ɴ�С��˳��Ϊ ����������Ũ�ȷ��ű�ʾ��
����6��һ���¶��£���ˮ����SO2���壬���õ�pH=5��H2SO3��Һ������Һ��������������Ӻ�����������ӵ����ʵ���Ũ��֮��Ϊ ���� ������֪���¶���H2SO3�ĵ��볣����Ka1=1.0��10-2mol/L��Ka2=6.0��10-3mol/L��
�������ڹ�ҵ�������й㷺����;��
��1�����ڿ��淴Ӧ2SO2(g)��O2(g)
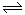 2SO3(g) ��H��0�������о�Ŀ�ĺ�ͼʾ�������
2SO3(g) ��H��0�������о�Ŀ�ĺ�ͼʾ������� ������ţ�
| ��� | A | B | C | D |
| Ŀ�� | ѹǿ��ƽ���Ӱ�� | �¶ȶ�ת���ʵ�Ӱ�� | ����O2Ũ�ȶ����ʵ�Ӱ�� | Ũ�ȶ�ƽ�ⳣ����Ӱ�� |
| ͼʾ | 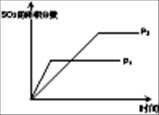 |  | 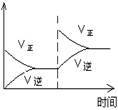 |  |
�ҡ����>����<����="��" ��
��3����2L�ļ������г���2molSO2��1molO2�����SO2��ƽ��ת�������¶ȵĹ�ϵ����ͼ��ʾ��

��.��T1�¶��£���Ӧ���е�״̬Dʱ��v�� v�������>����<����="��" ��
��.T3�¶��£�ƽ��ʱ��÷�Ӧ�ų�������ΪQ1������ͬ�¶���������������ͨ��2molSO2��1molO2�����´ﵽƽ�⣬��÷�Ӧ�ַų�����Q2 ��������˵������ȷ���� ��������ţ�
A����ͬ�¶�����ƽ��ʱ�����е�ѹǿ��ԭƽ��ʱ������
B��Q2һ������Q1
C����ƽ��ʱSO2��ת����һ������80%
��
��4���ڼ������г���һ������SO2��1.100molO2���ڴ��������¼��ȣ�����������ʵ�������0.315molʱ��Ӧ�ﵽƽ�⣬��ʱ�������ѹǿΪ��Ӧǰ��82.5%����SO2��ת����Ϊ ��
����5����������������Һ����SO2����ǡ�õõ���ʽ�Σ���֪����ʽ����Һ�������ԣ�����Һ�и�����Ũ���ɴ�С��˳��Ϊ ����������Ũ�ȷ��ű�ʾ��
����6��һ���¶��£���ˮ����SO2���壬���õ�pH=5��H2SO3��Һ������Һ��������������Ӻ�����������ӵ����ʵ���Ũ��֮��Ϊ ���� ������֪���¶���H2SO3�ĵ��볣����Ka1=1.0��10-2mol/L��Ka2=6.0��10-3mol/L��
(ÿ��2�֣���14��)
��1�� C ���д���0�֣�
(2) <
(3) I > II B C����һ����1�֣��д���0�֣�
(4) 90%
(5) c (Na+) ��c (HSO3��) ��c (H+)��c (SO32��)��c (OH��) �����0�� ��
��6��1/6 ��10-2 ��1.67 ��10-3
��1�� C ���д���0�֣�
(2) <
(3) I > II B C����һ����1�֣��д���0�֣�
(4) 90%
(5) c (Na+) ��c (HSO3��) ��c (H+)��c (SO32��)��c (OH��) �����0�� ��
��6��1/6 ��10-2 ��1.67 ��10-3
�����������1��A����ͼ��֪��P1>P2��ѹǿ����ƽ�������ƶ�������������������Ӧ������ͼ����������B���÷�ӦΪ���ȷ�Ӧ���¶����ߣ�ƽ�������ƶ������������ת���ʽ��ͣ���ͼ����������C������������Ũ�ȣ�����Ӧ���������淴Ӧ���ʲ��䣬ƽ�������ƶ�����ͼ���ϣ���ȷ��D������Ũ�������¶Ȳ��䣬ƽ�ⳣ�����䣬��ͼ����������ѡC��
��2����ʼʱ�ס�����������ѹǿ��ͬ����ƽ��ʱ����������ѹǿС���ң����Լ�����������ѹǿ���ܴﵽ��������ѹǿ��������ѹǿ��ƽ�������ƶ���������������������������SO3�����������<�ң�
��3��I��T1�¶�ʱA��������¶ȵĶ�������ƽ��ת���ʣ�D��Ķ��������ת���ʵ���A�㣬˵����Ӧδ��ƽ�⣬����v��>v����
II�����º���ʱ�����������ͨ��2molSO2��1molO2����Ӧ��Ũ����ԭ����2������ԭƽ��Ļ����ϣ�ƽ�������ƶ�������������ѹǿ��С�ķ������Դ���ƽ��ʱѹǿ����ԭƽ��ʱ��ѹǿ��С������ԭƽ���ѹǿ���ų���������Q1�࣬���������ת������ߣ����Դ�ѡBC��
��4������������������ʵ���Ϊamol��ÿ����2mol ������������������ʵ�������1mol��������������ʵ�������0.315mol��˵�����Ķ�������0.63mol����������0.315mol��������������0.63mol�����ݺ�����ѹǿ֮�ȵ����������ʵ���֮�ȣ���(a-0.63+0.63+1.1-0.315)/(a+1.1)=82.5%,���a=0.7,����SO2��ת����Ϊ0.63mol/0.7mol��100%=90%��
��5�������������������Ʒ�Ӧ����ʽ��Ϊ���������ƣ���Һ�����ԣ�˵��HSO3���ĵ���̶ȴ���ˮ��̶ȣ���Һ������Ũ�ȵĴ�С˳��Ϊ c (Na+) ��c (HSO3��) ��c (H+)��c (SO32��)��c (OH��)
��6����Һ�е�c (H+)=1��10-5mol/L��ƽ��ʱKa2=6.0��10-3mol/L=c (SO32��)c (H+)/c (HSO3��),����c (HSO3��)/c (SO32��)="c" (H+)/Ka2=1/6 ��10-2��

��ϰ��ϵ�д�
 ��ս�п�����ϵ�д�
��ս�п�����ϵ�д�
�����Ŀ

 2SO3(g) ���÷�Ӧ��ƽ�ⳣ������ʽΪK= ��������SO2��NaOH��Һ��Ӧ�Ļ�ѧ����ʽΪ
2SO3(g) ���÷�Ӧ��ƽ�ⳣ������ʽΪK= ��������SO2��NaOH��Һ��Ӧ�Ļ�ѧ����ʽΪ  2BaO(s)+O2(g)�ﵽƽ�⡣�����¶Ȳ��䣬��С�����ݻ�����ϵ���´ﵽƽ�⣬����˵����ȷ����
2BaO(s)+O2(g)�ﵽƽ�⡣�����¶Ȳ��䣬��С�����ݻ�����ϵ���´ﵽƽ�⣬����˵����ȷ���� Cr2O72- + H2O�� K��1��1014������0.05mol K2Cr2O7���Ƴ�1 L K2CrO4��Һ������c(Cr2O72��)��10��5mol/L����������Һ��pH
Cr2O72- + H2O�� K��1��1014������0.05mol K2Cr2O7���Ƴ�1 L K2CrO4��Һ������c(Cr2O72��)��10��5mol/L����������Һ��pH
 Fe��s����CO2��g����������ҵ��һ����Ҫ��Ӧ�����¶���ƽ�ⳣ��K�Ĺ�ϵ���±���
Fe��s����CO2��g����������ҵ��һ����Ҫ��Ӧ�����¶���ƽ�ⳣ��K�Ĺ�ϵ���±���
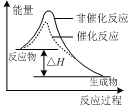
 2SO3��g�� ��H��0��2min��Ӧ�ﵽƽ�⣬����SO3Ϊ1.4mol,ͬʱ�ų�����Q kJ�������з�����ȷ����
2SO3��g�� ��H��0��2min��Ӧ�ﵽƽ�⣬����SO3Ϊ1.4mol,ͬʱ�ų�����Q kJ�������з�����ȷ����