题目内容
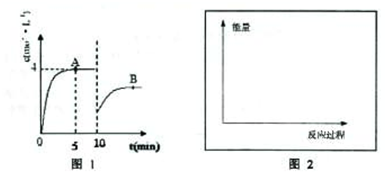
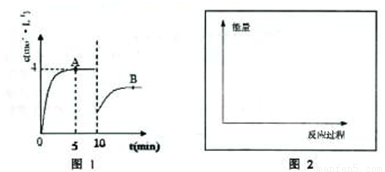
在一定条件下,合成塔中氮气和氢气的起始浓度分别为a mol?L-1和b mol?L-1,反应为:N2+3H2?2NH3,氨气的浓度随时间变化如图所示.(1)反应到5min时,氢气反应速率 .A的平衡常数为 (用含a,b的表达式表示)
(2)在10min时采取的措施是 ;
(3)-50°C时,液氨存在如下电离:2NH3?NH4++NH-2,K=2×10-12,往液氨中加入NH4Cl固体,K 2×10-12(填“<”、“>”或“=”)
(4)已知2A2(g)+B2(g)═2C3(g);△H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2mol A2和1mol B2,在500℃时充分反应达平衡后C3的浓度为w mol/L,放出热量b kJ.若在原来的容器中,只加入2mol C3,500℃时充分反应达平衡后,吸收热量c kJ,a、b、c之间满足何种关系 (用代数式表示)

【答案】分析:(1)由图可知,反应到5min时达平衡状态,氨气的浓度为4mol/L,根据v= 计算v(NH3),再利用速率之比等于化学计量数之比计算v(H2);
计算v(NH3),再利用速率之比等于化学计量数之比计算v(H2);
根据三段式计算平衡时各组分的浓度,代入平衡常数k= 计算;
计算;
(2)由图可知,10min瞬间改变条件,NH3的浓度为原平衡的一半,随后氨气的浓度增大,改变条件平衡向生成氨气的方向移动,应该是移走氨气的物质的量,降低氨气的浓度;
(3)电离平衡常数只受温度影响,温度不变,电离平衡常数不变,离子浓度无关;
(4)反应前后气体的体积发生变化,恒温恒容下,加入2mol C3,按化学计量数转化到左边,可得到2molA2(g)、1molB2(g),与开始加入2mol A2和1mol B2为等效平衡,平衡时对应组分的物质的量相等,令平衡时容器内C3的物质的量为xmol,根据方程式计算两种状态到达平衡时参加反应的A2、C3物质的量,在根据热化学方程式计算热量,据此计算解答.
解答:解:(1)由图可知,反应到5min时达平衡状态,氨气的浓度为4mol/L,故v(NH3)= =0.8mol/(L?min),速率之比等于化学计量数之比,
=0.8mol/(L?min),速率之比等于化学计量数之比,
故v(H2)= v(NH3)=
v(NH3)= ×0.8mol/(L?min)=1.2mol/(L?min),
×0.8mol/(L?min)=1.2mol/(L?min),
N2+3H2?2NH3,
开始(mol/L):a b 0
变化(mol/L):2 6 4
平衡(mol/L):a-2 b-6 4
故平衡常数k= =
=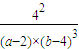 =
=
故答案为:1.2mol/(L?min); ;
;
(2)由图可知,10min瞬间改变条件,NH3的浓度为原平衡的一半,随后氨气的浓度增大,改变条件平衡向生成氨气的方向移动,应该是移走氨气的物质的量,降低氨气的浓度,
故答案为:移走生成的氨气,降低氨气的浓度;
(3)电离平衡常数只受温度影响,温度不变,电离平衡常数不变,离子浓度无关,故答案为:=;
(4)反应前后气体的体积发生变化,恒温恒容下,加入2mol C3,按化学计量数转化到左边,可得到2molA2(g)、1molB2(g),与开始加入2mol A2和1mol B2为等效平衡,平衡时对应组分的物质的量相等,令平衡时容器内C3的物质的量为xmol,则:
对于开始加入2mol A2和1mol B2,根据2A2(g)+B2(g)═2C3(g)可知,参加反应的A2的物质的量为xmol,故放出的热量为akJ×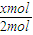 =0.5axkJ,即b=0.5ax,
=0.5axkJ,即b=0.5ax,
对于只加入2mol C3,由反应2C3(g)?2A2(g)+B2(g),参加反应的C3的物质的量为(2-x)mol,故该反应吸收的热量为akJ× =(1-0.5x)akJ,即c=(1-0.5x)a,
=(1-0.5x)akJ,即c=(1-0.5x)a,
故b+c=a,
故答案为:b+c=a.
点评:本题考查化学反应速率计算、平衡常数有关计算与影响因素、化学平衡图象与影响因素、等效平衡、反应热的有关计算等,题目综合性较大,难度中等,注意(4)中对于同一可逆反应,在相同温度下,正逆反应的反应热数值相等,符号相反.
 计算v(NH3),再利用速率之比等于化学计量数之比计算v(H2);
计算v(NH3),再利用速率之比等于化学计量数之比计算v(H2);根据三段式计算平衡时各组分的浓度,代入平衡常数k=
 计算;
计算;(2)由图可知,10min瞬间改变条件,NH3的浓度为原平衡的一半,随后氨气的浓度增大,改变条件平衡向生成氨气的方向移动,应该是移走氨气的物质的量,降低氨气的浓度;
(3)电离平衡常数只受温度影响,温度不变,电离平衡常数不变,离子浓度无关;
(4)反应前后气体的体积发生变化,恒温恒容下,加入2mol C3,按化学计量数转化到左边,可得到2molA2(g)、1molB2(g),与开始加入2mol A2和1mol B2为等效平衡,平衡时对应组分的物质的量相等,令平衡时容器内C3的物质的量为xmol,根据方程式计算两种状态到达平衡时参加反应的A2、C3物质的量,在根据热化学方程式计算热量,据此计算解答.
解答:解:(1)由图可知,反应到5min时达平衡状态,氨气的浓度为4mol/L,故v(NH3)=
 =0.8mol/(L?min),速率之比等于化学计量数之比,
=0.8mol/(L?min),速率之比等于化学计量数之比,故v(H2)=
 v(NH3)=
v(NH3)= ×0.8mol/(L?min)=1.2mol/(L?min),
×0.8mol/(L?min)=1.2mol/(L?min),N2+3H2?2NH3,
开始(mol/L):a b 0
变化(mol/L):2 6 4
平衡(mol/L):a-2 b-6 4
故平衡常数k=
 =
=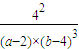 =
=
故答案为:1.2mol/(L?min);
 ;
;(2)由图可知,10min瞬间改变条件,NH3的浓度为原平衡的一半,随后氨气的浓度增大,改变条件平衡向生成氨气的方向移动,应该是移走氨气的物质的量,降低氨气的浓度,
故答案为:移走生成的氨气,降低氨气的浓度;
(3)电离平衡常数只受温度影响,温度不变,电离平衡常数不变,离子浓度无关,故答案为:=;
(4)反应前后气体的体积发生变化,恒温恒容下,加入2mol C3,按化学计量数转化到左边,可得到2molA2(g)、1molB2(g),与开始加入2mol A2和1mol B2为等效平衡,平衡时对应组分的物质的量相等,令平衡时容器内C3的物质的量为xmol,则:
对于开始加入2mol A2和1mol B2,根据2A2(g)+B2(g)═2C3(g)可知,参加反应的A2的物质的量为xmol,故放出的热量为akJ×
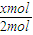 =0.5axkJ,即b=0.5ax,
=0.5axkJ,即b=0.5ax,对于只加入2mol C3,由反应2C3(g)?2A2(g)+B2(g),参加反应的C3的物质的量为(2-x)mol,故该反应吸收的热量为akJ×
 =(1-0.5x)akJ,即c=(1-0.5x)a,
=(1-0.5x)akJ,即c=(1-0.5x)a,故b+c=a,
故答案为:b+c=a.
点评:本题考查化学反应速率计算、平衡常数有关计算与影响因素、化学平衡图象与影响因素、等效平衡、反应热的有关计算等,题目综合性较大,难度中等,注意(4)中对于同一可逆反应,在相同温度下,正逆反应的反应热数值相等,符号相反.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目