摘要:11].配平下列离子氧化-还原反应 (1) An+ Bx-- Ay-+ Bm (2) Clm+ OH--ClOn-+ Cl-+ H2O (3) BiO3-+ Mn2++ H+- Bi3++ MnO4-+ H2O (4) VO2++ H2C2O4·2H2O+ H+- VO2++ CO2↑+ H2O
网址:http://m.1010jiajiao.com/timu3_id_194042[举报]
配平下列离子氧化还原反应
(1) A n + Bx- → Ay- + B m
(2) Cl2 + OH- → ClO![]() + Cl- + H2O
+ Cl- + H2O
(3) BiO![]() + Mn2+ + H+ → Bi3+ + MnO
+ Mn2+ + H+ → Bi3+ + MnO![]() + H2O
+ H2O
(4) VO![]() + H2C2O4?2H2O + H+ → VO2+ + CO2↑+ H2O
+ H2C2O4?2H2O + H+ → VO2+ + CO2↑+ H2O
 (2013?江西模拟)已知Ca(OH)2与Cl2反应的氧化产物与温度有关,在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应).生成物中含有Cl-、ClO-、Cl
(2013?江西模拟)已知Ca(OH)2与Cl2反应的氧化产物与温度有关,在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应).生成物中含有Cl-、ClO-、Cl| O | - 3 |
| O | - 3 |
(1)t1前,氧化产物是
Ca(ClO)2
Ca(ClO)2
(填化学式).(2)t2时,Ca(OH)2与Cl2发生反应的总的离子方程式为:
5Ca(OH)2+5Cl2=5Ca2++2ClO-+ClO3-+7Cl-+5H2O
5Ca(OH)2+5Cl2=5Ca2++2ClO-+ClO3-+7Cl-+5H2O
.(3)该石灰乳中含有Ca(OH)2的物质的量是
5
5
mol.(4)NaClO2较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,其爆炸后的产物可能是
D
D
(填字母).A.NaCl、Cl2 B.NaCl、NaClO C.NaClO3、NaClO4 D.NaCl、NaClO3
(5)配平下列离子方程式:
2
2
Fe(OH)3+(5-n)
(5-n)
ClO-+2n
2n
OH-----2
2
Fe| O | n- 4 |
(5-n)
(5-n)
Cl-+(n+3)
(n+3)
H2O.
工业上为从4J29合金(铁钴镍合金)废料中提取钴和镍,一般先用硫酸溶解合金使成为Fe2+、Co2+、Ni2+,再把Fe2+氧化为Fe3+,从而使Fe3+转化为某种沉淀析出,达到与Ni2+、Co3+分离的目的.生产上要使Fe2+氧化为Fe3+,而不使Co2+、Ni2+氧化的试剂是NaClO或NaClO3(均含少量H2SO4)溶液,反应的部分化学方程式如下(A为还原剂):??NaClO+A+B→NaCl+C+H2O
NaClO3+A+B→NaCl+C+H2O.
(1)请完成以上化学方程式: , .并回答实际生产上采用NaClO3来氧化Fe2+比较合算的理由: .
(2)配平下列离子方程式,并回答问题:
Fe(OH)3+ ClO-+ OH-→ FeO4n-+ Cl-+ H20?
(3)已知有3.21g Fe(OH)3参加反应,共转移了5.418×1022个电子,则n= .
(4)根据上述(2 ),(3)题推测FeO4n-能与下列哪些物质反应(只填序号) .
A.Cl2 B.SO2 C.H2S D.O2? 查看习题详情和答案>>
NaClO3+A+B→NaCl+C+H2O.
(1)请完成以上化学方程式:
(2)配平下列离子方程式,并回答问题:
(3)已知有3.21g Fe(OH)3参加反应,共转移了5.418×1022个电子,则n=
(4)根据上述(2 ),(3)题推测FeO4n-能与下列哪些物质反应(只填序号)
A.Cl2 B.SO2 C.H2S D.O2? 查看习题详情和答案>>
(2009?广东模拟)铁是人体不可缺少的微量元素,摄入含铁的化合物可补充铁.“速力菲”是市场上一种常见的补铁药物,下表格是它的说明书.

(1)该药品中Fe2+ 会缓慢氧化,国家规定该药物中Fe2+ 的氧化率超过10%即不能再服用.
1为了检验某药店出售的“速力菲”是否氧化,实验室可选用最常用最灵敏的检验试剂为
②实验室采用H2SO4酸化的KMnO4溶液,对“速力菲”中的Fe2+ 进行滴定(假设药品中,其它成分不与KMnO4反应).请配平下列离子方程式
③称量上述含铁元素质量分数为20.00% 的“速力菲”10.00g,将其全部溶于稀硫酸中,配制成1000.00mL溶液,取出20.00mL,用0.01mol/L的KMnO4溶液滴定,用去KMnO4溶液12.00mL.该药品可以服用吗?
(2)已知琥珀酸亚铁相对分子质量为172,琥珀酸为有机酸.含23.6g琥珀酸的溶液与4mol/L 100mL的氢氧化钠溶液恰好完全中和.质子核磁共振分析显示,琥珀酸分子中只含有两种位置不同的氢原子.写出琥珀酸溶液与氢氧化钠溶液完全中和的离子方程式(有机物须写结构简式)
查看习题详情和答案>>

(1)该药品中Fe2+ 会缓慢氧化,国家规定该药物中Fe2+ 的氧化率超过10%即不能再服用.
1为了检验某药店出售的“速力菲”是否氧化,实验室可选用最常用最灵敏的检验试剂为
硫氰化钾溶液
硫氰化钾溶液
( 填试剂的名称 )②实验室采用H2SO4酸化的KMnO4溶液,对“速力菲”中的Fe2+ 进行滴定(假设药品中,其它成分不与KMnO4反应).请配平下列离子方程式
1
1
MnO4-+5
5
Fe2++8
8
H+═1
1
Mn2++5
5
Fe3++4
4
H2O③称量上述含铁元素质量分数为20.00% 的“速力菲”10.00g,将其全部溶于稀硫酸中,配制成1000.00mL溶液,取出20.00mL,用0.01mol/L的KMnO4溶液滴定,用去KMnO4溶液12.00mL.该药品可以服用吗?
不可以
不可以
(填“可以”或“不可以”),请通过计算简述理由(写出主要计算过程)由MnO4-~5Fe2+,可得1000.00mL溶液含有的Fe2+的物质的量n(Fe2+)=0.01mol/L×12.00×10-3L×5×(1000.00mL/20.00mL)=0.03mol,m(Fe2+)=0.03mol×56g/mol=1.68g,Fe2+的氧化率(10g×20.00%-1.68g)/(10g×20.00%)=16.00%>10%,所以不可以服用.
由MnO4-~5Fe2+,可得1000.00mL溶液含有的Fe2+的物质的量n(Fe2+)=0.01mol/L×12.00×10-3L×5×(1000.00mL/20.00mL)=0.03mol,m(Fe2+)=0.03mol×56g/mol=1.68g,Fe2+的氧化率(10g×20.00%-1.68g)/(10g×20.00%)=16.00%>10%,所以不可以服用.
.(2)已知琥珀酸亚铁相对分子质量为172,琥珀酸为有机酸.含23.6g琥珀酸的溶液与4mol/L 100mL的氢氧化钠溶液恰好完全中和.质子核磁共振分析显示,琥珀酸分子中只含有两种位置不同的氢原子.写出琥珀酸溶液与氢氧化钠溶液完全中和的离子方程式(有机物须写结构简式)
HOOC-CH2-CH2-COOH+2OH-→-OOC-CH2-CH2-COO-+2H2O
HOOC-CH2-CH2-COOH+2OH-→-OOC-CH2-CH2-COO-+2H2O
,琥珀酸亚铁的化学式为FeC4H4O4
FeC4H4O4
.工业上为从4J29合金(铁钴镍合金)废料中提取钴和镍,一般先用硫酸溶解合金,使其转化为Fe2+、Co2+、Ni2+,再把Fe2+氧化为Fe3+,从而使Fe3+转化为某种沉淀析出,达到与Ni2+、Co2+分离的目的.生产上要使Fe2+氧化为Fe3+,而不使Co2+、Ni2+氧化的试剂是NaClO或NaClO3(均含少量H2SO4)溶液.反应的部分化学方程式如下(A为还原剂):?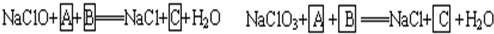
试回答下列问题:
(1)上述反应中,A为:
(2)配平下列离子方程式:?
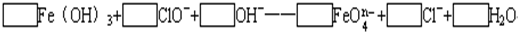
(3)已知有3.21g Fe(OH)3参加反应,共转移了5.42×1022个电子,则n=
中铁的化合价为
(4)根据(2)、(3)推测FeO
能与下列哪些物质反应(只填序号)
A.Cl2 B.SO2C.H2S D.O2?
查看习题详情和答案>>
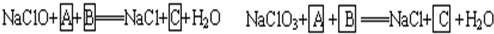
试回答下列问题:
(1)上述反应中,A为:
FeSO4
FeSO4
(写化学式,下同),C为:Fe2(SO4)3
Fe2(SO4)3
.(2)配平下列离子方程式:?
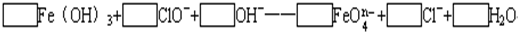
(3)已知有3.21g Fe(OH)3参加反应,共转移了5.42×1022个电子,则n=
2
2
,FeOn- 4 |
+6
+6
.(4)根据(2)、(3)推测FeO
n- 4 |
BC
BC
.A.Cl2 B.SO2C.H2S D.O2?