题目内容
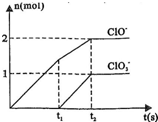 (2013?江西模拟)已知Ca(OH)2与Cl2反应的氧化产物与温度有关,在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应).生成物中含有Cl-、ClO-、Cl
(2013?江西模拟)已知Ca(OH)2与Cl2反应的氧化产物与温度有关,在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应).生成物中含有Cl-、ClO-、Cl| O | - 3 |
| O | - 3 |
(1)t1前,氧化产物是
Ca(ClO)2
Ca(ClO)2
(填化学式).(2)t2时,Ca(OH)2与Cl2发生反应的总的离子方程式为:
5Ca(OH)2+5Cl2=5Ca2++2ClO-+ClO3-+7Cl-+5H2O
5Ca(OH)2+5Cl2=5Ca2++2ClO-+ClO3-+7Cl-+5H2O
.(3)该石灰乳中含有Ca(OH)2的物质的量是
5
5
mol.(4)NaClO2较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,其爆炸后的产物可能是
D
D
(填字母).A.NaCl、Cl2 B.NaCl、NaClO C.NaClO3、NaClO4 D.NaCl、NaClO3
(5)配平下列离子方程式:
2
2
Fe(OH)3+(5-n)
(5-n)
ClO-+2n
2n
OH-----2
2
Fe| O | n- 4 |
(5-n)
(5-n)
Cl-+(n+3)
(n+3)
H2O.分析:(1)氧化还原反应在的氧化产物是还原剂被氧化生成的物质,化合价在变化中升高;
(2)t2时,Ca(OH)2与Cl2发生反应,依据图象分析可知生成次氯酸根和氯酸根离子物质的量之比为2:1,依据题干条件结合离子方程式的书写原则电荷守恒、原子守恒配平方程式,注意石灰乳氢氧化钙些化学式;
(3)该石灰乳中含有Ca(OH)2的物质的量依据图象和离子方程式推算,t2时,氯气和氢氧化钙恰好全部反应,所以氢氧化钙物质的量为5mol;
(4)NaClO2较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,发生氧化还原反应,氯元素化合价从+3价升降,即其爆炸后的产物中 的氯元素化合价有大于+3价和小于+3价的化合物;
(5)依据氧化还原反应的化合价升降总数相同来分析配平,检查原子守恒、电荷守恒;
(2)t2时,Ca(OH)2与Cl2发生反应,依据图象分析可知生成次氯酸根和氯酸根离子物质的量之比为2:1,依据题干条件结合离子方程式的书写原则电荷守恒、原子守恒配平方程式,注意石灰乳氢氧化钙些化学式;
(3)该石灰乳中含有Ca(OH)2的物质的量依据图象和离子方程式推算,t2时,氯气和氢氧化钙恰好全部反应,所以氢氧化钙物质的量为5mol;
(4)NaClO2较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,发生氧化还原反应,氯元素化合价从+3价升降,即其爆炸后的产物中 的氯元素化合价有大于+3价和小于+3价的化合物;
(5)依据氧化还原反应的化合价升降总数相同来分析配平,检查原子守恒、电荷守恒;
解答:解:(1)氧化还原反应在的氧化产物是还原剂被氧化生成的物质,化合价在变化中升高,即氯元素化合价升高生成的产物,结合图象分析,t1前,氧化产物只有Ca(ClO)2;故答案为:Ca(ClO)2;
(2)t2时,Ca(OH)2与Cl2发生反应,依据图象分析可知生成次氯酸根和氯酸根离子物质的量之比为2:1,依据题干条件结合离子方程式的书写原则电荷守恒、原子守恒配平方程式,
5Ca(OH)2+5Cl2=5Ca2++2ClO-+ClO3-+7Cl-+5H2O;
故答案为:5Ca(OH)2+5Cl2=5Ca2++2ClO-+ClO3-+7Cl-+5H2O;
(3)t2时,氢氧化钙和氯气恰好反应,依据反应的离子方程式可知:
5Ca(OH)2+5Cl2=5Ca2++2ClO-+ClO3-+7Cl-+5H2O;消耗氢氧化钙物质的量为:5mol;故答案为:5mol;
(4)NaClO2较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,发生氧化还原反应,氯元素化合价从+3价升降,即其爆炸后的产物中 的氯元素化合价有大于+3价和小于+3价的化合物;
A、中氯元素化合价为-1和0价;不符合;
B、氯元素化合价-1和+1价;不符合;
C、氯元素化合价为+5和+7价,不符合;
D、氯元素化合价为-1和+5价,符合;
故答案为:D
(5)依据化合价变化:ClO-~Cl-~2e-;Fe(OH)3~FeO4n-~(5-n)e-;电子转移总数2(5-n),结合离子方程式的电子守恒、电荷守恒、原子守恒进行分析配平,写出离子方程式为:
2Fe(OH)3+(5-n)ClO-+2nOH-=2FeO4n-+(5-n)Cl-+(3+n)H2O
故答案为:2,(5-n),2n,2,(5-n),(n+3).
(2)t2时,Ca(OH)2与Cl2发生反应,依据图象分析可知生成次氯酸根和氯酸根离子物质的量之比为2:1,依据题干条件结合离子方程式的书写原则电荷守恒、原子守恒配平方程式,
5Ca(OH)2+5Cl2=5Ca2++2ClO-+ClO3-+7Cl-+5H2O;
故答案为:5Ca(OH)2+5Cl2=5Ca2++2ClO-+ClO3-+7Cl-+5H2O;
(3)t2时,氢氧化钙和氯气恰好反应,依据反应的离子方程式可知:
5Ca(OH)2+5Cl2=5Ca2++2ClO-+ClO3-+7Cl-+5H2O;消耗氢氧化钙物质的量为:5mol;故答案为:5mol;
(4)NaClO2较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,发生氧化还原反应,氯元素化合价从+3价升降,即其爆炸后的产物中 的氯元素化合价有大于+3价和小于+3价的化合物;
A、中氯元素化合价为-1和0价;不符合;
B、氯元素化合价-1和+1价;不符合;
C、氯元素化合价为+5和+7价,不符合;
D、氯元素化合价为-1和+5价,符合;
故答案为:D
(5)依据化合价变化:ClO-~Cl-~2e-;Fe(OH)3~FeO4n-~(5-n)e-;电子转移总数2(5-n),结合离子方程式的电子守恒、电荷守恒、原子守恒进行分析配平,写出离子方程式为:
2Fe(OH)3+(5-n)ClO-+2nOH-=2FeO4n-+(5-n)Cl-+(3+n)H2O
故答案为:2,(5-n),2n,2,(5-n),(n+3).
点评:本题考查了氯气性质应用,氯气和氢氧化钙反应的图象分析判断,离子方程式的书写方法,氧化还原反应的电子守恒方法配平离子方程式,氧化还原反应的化合价变化特征应用,题目难度中等.

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案
相关题目
 (2013?江西模拟)甲醇是一种很好的燃料,工业上用CH4和H2O为原料,通过下述反应Ⅰ和Ⅱ来制备甲醇.
(2013?江西模拟)甲醇是一种很好的燃料,工业上用CH4和H2O为原料,通过下述反应Ⅰ和Ⅱ来制备甲醇.