题目内容
工业上为从4J29合金(铁钴镍合金)废料中提取钴和镍,一般先用硫酸溶解合金,使其转化为Fe2+、Co2+、Ni2+,再把Fe2+氧化为Fe3+,从而使Fe3+转化为某种沉淀析出,达到与Ni2+、Co2+分离的目的.生产上要使Fe2+氧化为Fe3+,而不使Co2+、Ni2+氧化的试剂是NaClO或NaClO3(均含少量H2SO4)溶液.反应的部分化学方程式如下(A为还原剂):?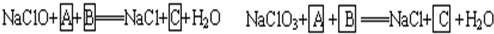
试回答下列问题:
(1)上述反应中,A为:
(2)配平下列离子方程式:?
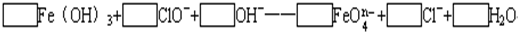
(3)已知有3.21g Fe(OH)3参加反应,共转移了5.42×1022个电子,则n=
中铁的化合价为
(4)根据(2)、(3)推测FeO
能与下列哪些物质反应(只填序号)
A.Cl2 B.SO2C.H2S D.O2?
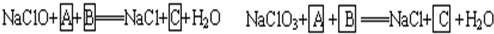
试回答下列问题:
(1)上述反应中,A为:
FeSO4
FeSO4
(写化学式,下同),C为:Fe2(SO4)3
Fe2(SO4)3
.(2)配平下列离子方程式:?
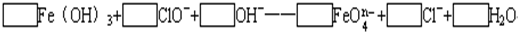
(3)已知有3.21g Fe(OH)3参加反应,共转移了5.42×1022个电子,则n=
2
2
,FeOn- 4 |
+6
+6
.(4)根据(2)、(3)推测FeO
n- 4 |
BC
BC
.A.Cl2 B.SO2C.H2S D.O2?
分析:(1)根据题意知,次氯酸钠和氯酸钠都是氧化剂,A是还原剂,则A失电子化合价升高,且溶液中含有硫酸,根据元素守恒判断A物质、C物质;
(2)根据氧化还原反应中得失电子数相等结合电荷守恒、原子守恒配平方程式;
(3)根据氢氧化铁和转移电子之间的关系式计算n值,再根据离子中化合价的代数和与其所带电荷数相等计算铁的化合价;
(4)根据高铁酸根离子中铁元素的化合价知高铁酸根离子具有强氧化性,能和强还原性的物质反应.
(2)根据氧化还原反应中得失电子数相等结合电荷守恒、原子守恒配平方程式;
(3)根据氢氧化铁和转移电子之间的关系式计算n值,再根据离子中化合价的代数和与其所带电荷数相等计算铁的化合价;
(4)根据高铁酸根离子中铁元素的化合价知高铁酸根离子具有强氧化性,能和强还原性的物质反应.
解答:解:(1)根据题意知,次氯酸钠和氯酸钠都是氧化剂,A是还原剂,则A失电子化合价升高,且溶液中含有硫酸,所以A中含有硫酸根离子且具有还原性,结合实验目的把Fe2+氧化为Fe3+从而使Fe3+转化为某种沉淀析出知,A是硫酸亚铁,B是硫酸,结合元素守恒知,C是硫酸铁,
故答案为:FeSO4,Fe2(SO4)3;
(2)该反应中铁元素的化合价+3→+(8-n),失去(5-n)个电子,氯元素的化合价+1→-1价,得到2个电子,得失电子的最小公倍数是2(5-n),所以氢氧化铁的计量数是2,次氯酸根离子的计量数是5-n,然后根据原子守恒配平方程式得
2Fe(OH)3+(5-n)ClO-+2nOH-=2 FeO4n-+(5-n)Cl-+(n+3)H2O,
故答案为2、5-n、2n、2、5-n、n+3;
(3)2Fe(OH)3+(5-n)ClO-+2nOH-=2FeO4n-+(5-n)Cl-+(n+3)H2O转移电子
214g 2(5-n)×6.02×1023
3.21g 5.42×1022
n=5-
=2,FeO42-中铁的化合价=-2-(-2)×4=+6,
故答案为:2,+6;
(4)FeO42-中铁元素化合价是最高价,所以该离子具有强氧化性,能和强还原性的物质反应,氯气和氧气具有强氧化性,所以不能和高铁酸根离子反应,二氧化硫和硫化氢具有强还原性,所以能和高铁酸根离子反应,故选B、C.
故答案为:FeSO4,Fe2(SO4)3;
(2)该反应中铁元素的化合价+3→+(8-n),失去(5-n)个电子,氯元素的化合价+1→-1价,得到2个电子,得失电子的最小公倍数是2(5-n),所以氢氧化铁的计量数是2,次氯酸根离子的计量数是5-n,然后根据原子守恒配平方程式得
2Fe(OH)3+(5-n)ClO-+2nOH-=2 FeO4n-+(5-n)Cl-+(n+3)H2O,
故答案为2、5-n、2n、2、5-n、n+3;
(3)2Fe(OH)3+(5-n)ClO-+2nOH-=2FeO4n-+(5-n)Cl-+(n+3)H2O转移电子
214g 2(5-n)×6.02×1023
3.21g 5.42×1022
n=5-
| 214×5.42×1022 |
| 3.21×2×6.02×1023 |
故答案为:2,+6;
(4)FeO42-中铁元素化合价是最高价,所以该离子具有强氧化性,能和强还原性的物质反应,氯气和氧气具有强氧化性,所以不能和高铁酸根离子反应,二氧化硫和硫化氢具有强还原性,所以能和高铁酸根离子反应,故选B、C.
点评:本题考查了氧化还原反应及其配平,难度不大,根据得失电子数相等来配平方程式即可,注意元素化合价的判断.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
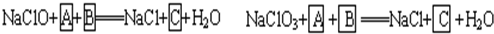

 中铁的化合价为______.
中铁的化合价为______.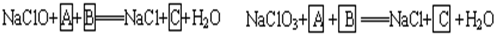

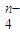 中铁的化合价为 .
中铁的化合价为 .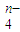 能与下列哪些物质反应(只填序号) .
能与下列哪些物质反应(只填序号) .