摘要:2=Ba2++2OH-(2)NH4HSO4=NH4++HSO4- (3)NaHCO3=Na++HCO3-(4)BaSO4=Ba2++SO42- B组能力提升答案:
网址:http://m.1010jiajiao.com/timu3_id_193255[举报]
(1)写出下列反应的离子方程:
①在NaOH溶液通入少量二氧化碳:
②向NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性:
(2)软锰矿(MnO2)和过量的固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl,写出软锰矿制备K2MnO4的化学方程式,并标出电子转移的方向和数目:
查看习题详情和答案>>
①在NaOH溶液通入少量二氧化碳:
CO2+2OH-═CO32-+H2O
CO2+2OH-═CO32-+H2O
.②向NaHSO4溶液中逐滴加入Ba(OH)2溶液至中性:
Ba2++SO42-+2OH-+2H+=BaSO4↓+2H2O
Ba2++SO42-+2OH-+2H+=BaSO4↓+2H2O
.(2)软锰矿(MnO2)和过量的固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl,写出软锰矿制备K2MnO4的化学方程式,并标出电子转移的方向和数目:
3MnO2+6KOH+KClO3
3K2MnO4+KCl+3H2O,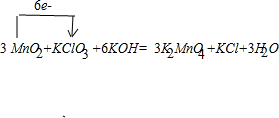
| ||
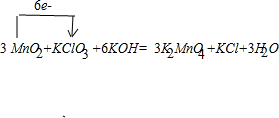
3MnO2+6KOH+KClO3
3K2MnO4+KCl+3H2O,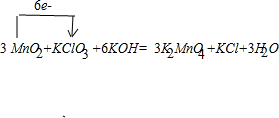
.
| ||
从海水中直接晒出的盐为粗盐,含有多种不溶性及可溶性杂质.除泥沙外,主要含有SO42-、Mg2+、Ca2+等,现有下列步骤用于除杂并得到纯净的食盐.
(a)取一定量的粗盐溶于水;
(b)过滤;
(c)加BaCl2溶液;
(d)加NaOH溶液;
(e)加稀盐酸调节溶液pH值;
(f)加Na2CO3溶液;
(g)蒸发;
回答:
(1)上述步骤的正确操作顺序为a
(2)步骤c的目的是
(3)步骤f不仅可以除去粗盐中含有的
查看习题详情和答案>>
(a)取一定量的粗盐溶于水;
(b)过滤;
(c)加BaCl2溶液;
(d)加NaOH溶液;
(e)加稀盐酸调节溶液pH值;
(f)加Na2CO3溶液;
(g)蒸发;
回答:
(1)上述步骤的正确操作顺序为a
dcfbe
dcfbe
g(每步只能进行一次)(2)步骤c的目的是
除去杂质离子镁离子
除去杂质离子镁离子
,有关离子方程Mg2++2OH-=Mg(OH)2↓
Mg2++2OH-=Mg(OH)2↓
.(3)步骤f不仅可以除去粗盐中含有的
Ca2+
Ca2+
(填离子符号),还可以除去加入的过量的Ba2+
Ba2+
(填离子符号),有关的离子方程式Ca2++CO32-=CaCO3↓
Ca2++CO32-=CaCO3↓
、Ba2++CO32-=BaCO3↓
Ba2++CO32-=BaCO3↓
.