摘要:原子结构示意图 练习:写出下列原子或离子的结构示意图: Li 15号元素 S2- 55号元素 38号元素的离子 (1)电子层数=阳离子的电子层数+1=周期数 主族元素最外层电子数=最高正价=主族数=8-|最低负价| (2)原子或离子半径的判断方法: ①根据核外电子层结构: A 电子层数越多.半径 , B 电子层数相同时.核电荷数越在.半径 . ②根据周期表中的位置: A 同主族的原子或离子半径依次 ,B 同一周期的主族元素从左至右依次 . (3)写出下列主族元素的离子符号: 核外2个电子的结构(He)的离子有 , 核外10个电子的结构(Ne)的离子有 , 核外18个电子的结构(Ar)的离子有 , 例题6.已知两种主族元素的离子aXm+与bYn-核外均有18个电子.试确定: (1)a .m.b.n的相互关系 (2)X和Y的离子的半径大小比较 (3)比较X.Y的原子半径大小 (4)写出X的离子的图结构示意 Y的原子结构示意图 . (4)试确定X.Y在周期表中的位置
网址:http://m.1010jiajiao.com/timu3_id_193192[举报]
(2011?天津模拟)已知物质M由同一短周期的X、Y两种元素组成,X原子的最外层电子数是最内层电子数的一半,Y元素最高正价与它的负价代数和为6.M与其他物质的转化关系如图(部分产物已略去):
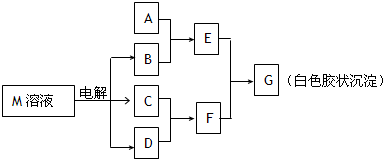
(1)若A是与X、Y同周期的一种常见金属,则A元素在周期表中的位置是
(2)若A是某元素的一种常见酸性氧化物,可用于制造光导纤维,则该元素原子结构示意图为
 ,写出E与F反应的离子方程式
,写出E与F反应的离子方程式
(3)B的电子式为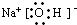
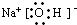 ,其中的化学键为
,其中的化学键为
 .
.
(4)工业上用电解物质M的产物之一氧化有毒含氰(CN-)碱性废水,得到无毒的N2、CO2等.写出此反应的离子反应方程式
查看习题详情和答案>>

(1)若A是与X、Y同周期的一种常见金属,则A元素在周期表中的位置是
第三
第三
周期第IIIA
第IIIA
族,写出A与B溶液反应的化学方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
.(2)若A是某元素的一种常见酸性氧化物,可用于制造光导纤维,则该元素原子结构示意图为


2H++SiO32-=H2SiO3↓
2H++SiO32-=H2SiO3↓
.(3)B的电子式为
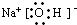
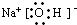
离子键和共价键
离子键和共价键
.用电子式表示M的形成过程

(4)工业上用电解物质M的产物之一氧化有毒含氰(CN-)碱性废水,得到无毒的N2、CO2等.写出此反应的离子反应方程式
5Cl2+2CN-+8OH-=10Cl-+N2+2CO2+4H2O
5Cl2+2CN-+8OH-=10Cl-+N2+2CO2+4H2O
.下表中列出了五种短周期元素A、B、C、D、E的信息,请推断后作答:
(1)写出A、B、C、D、E五种元素符号 、 、 、 、 .
(2)画出B的原子结构示意图: ;写出D元素最高价氧化物对应水化物的电子式: .
(3)盐X水溶液显 (选填“酸”、“碱”或“中”)性,用离子方程式解释其原因: .
(4)D2CA3的溶液与B的单质能发生氧化还原反应,其反应的离子方程式为 .
(5)已知E元素的某种氢化物Y与A2的摩尔质量相同,Y在常温下为液态,Y的化学式为 ,Y所含的化学键为 .
(a)极性键 (b)非极性键 (c)离子键.
查看习题详情和答案>>
| 元素 | 有关信息 |
| A | 元素主要化合价为-2,原子半径为0.074nm |
| B | 所在主族序数与所在周期序数之差为4,同周期主族元素中原子半径最小 |
| C | 原子半径为0.102nm,其单质在A的单质中燃烧,发出明亮的蓝紫色火焰 |
| D | 最高价氧化物对应水化物,能按1:1电离出电子数相等(10个电子)的阴阳离子 |
| E | 原子半径为0.075nm,最高价氧化物对应水化物与其氢化物组成一种盐X |
(2)画出B的原子结构示意图:
(3)盐X水溶液显
(4)D2CA3的溶液与B的单质能发生氧化还原反应,其反应的离子方程式为
(5)已知E元素的某种氢化物Y与A2的摩尔质量相同,Y在常温下为液态,Y的化学式为
(a)极性键 (b)非极性键 (c)离子键.
X、Y、Z是三种常见的单质.
(1)若X、Y、Z的组成元素为不同短周期非金属元素.常温下,X为淡黄色固体,X在Z中充分燃烧可生成B,B是形成酸雨的主要物质之一,A与B反应生成固体X和C,C在常温下为无色液体.
①写出A的化学式: ;
②写出氢氧化钠溶液中通入少量的B反应的化学方程式: ;
③在298K、101kPa时,已知:
A(g)+
(g)═C(l)+X(s);△H1=-288.93kJ?mol-1
A(g)+
Z(g)═C(l)+B(g);△H2=-586.16kJ?mol-1
写出反应X+Z→B的热化学方程式: .
(2)若X、Y、Z的组成元素为同一短周期金属元素,且原子序数依次增大.X、Z最高价氧化物对应的水化物之间能发生反应.
①写出Y组成的元素原子结构示意图: ;
②写出X、Z最高价氧化物对应的水化物之间反应的离子方程式: ;
③列举一例Z在生活、生产中的用途: .
查看习题详情和答案>>
(1)若X、Y、Z的组成元素为不同短周期非金属元素.常温下,X为淡黄色固体,X在Z中充分燃烧可生成B,B是形成酸雨的主要物质之一,A与B反应生成固体X和C,C在常温下为无色液体.
①写出A的化学式:
②写出氢氧化钠溶液中通入少量的B反应的化学方程式:
③在298K、101kPa时,已知:
A(g)+
| 1 |
| 2 |
A(g)+
| 3 |
| 2 |
写出反应X+Z→B的热化学方程式:
(2)若X、Y、Z的组成元素为同一短周期金属元素,且原子序数依次增大.X、Z最高价氧化物对应的水化物之间能发生反应.
①写出Y组成的元素原子结构示意图:
②写出X、Z最高价氧化物对应的水化物之间反应的离子方程式:
③列举一例Z在生活、生产中的用途:
(2011?东城区模拟)已知物质M由同一短周期的X、Y两种元素组成,X原子的最外层电子数是最内层电子数的一半,Y元素最高正价与它的负价代数和为6.M与其他物质的转化关系如下(部分产物已略去):
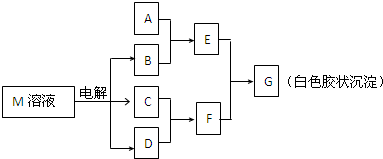
(1)工业电解M溶液的化学方程式为
(2)若A是X、Y同周期的一种常见金属,则A元素在周期表中的位置是
(3)若A是某元素的一种常见酸性氧化物,可用于制造光导纤维,则该元素原子结构示意图为
 ,写出E与F反应的离子方程式是
,写出E与F反应的离子方程式是
(4)B的电子式为: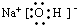
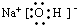 ,其中的化学键为:
,其中的化学键为:
(5)说明M物质的一种用途:
查看习题详情和答案>>

(1)工业电解M溶液的化学方程式为
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
| ||
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
.
| ||
(2)若A是X、Y同周期的一种常见金属,则A元素在周期表中的位置是
第三
第三
周期IIIA族
IIIA族
族,写出A与B溶液反应的化学方程式是2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
.(3)若A是某元素的一种常见酸性氧化物,可用于制造光导纤维,则该元素原子结构示意图为


2H++SiO32-=H2SiO3↓
2H++SiO32-=H2SiO3↓
.(4)B的电子式为:
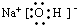
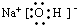
离子键和极性键
离子键和极性键
.(5)说明M物质的一种用途:
氯碱工业
氯碱工业
.