题目内容
X、Y、Z是三种常见的单质.
(1)若X、Y、Z的组成元素为不同短周期非金属元素.常温下,X为淡黄色固体,X在Z中充分燃烧可生成B,B是形成酸雨的主要物质之一,A与B反应生成固体X和C,C在常温下为无色液体.
①写出A的化学式: ;
②写出氢氧化钠溶液中通入少量的B反应的化学方程式: ;
③在298K、101kPa时,已知:
A(g)+
(g)═C(l)+X(s);△H1=-288.93kJ?mol-1
A(g)+
Z(g)═C(l)+B(g);△H2=-586.16kJ?mol-1
写出反应X+Z→B的热化学方程式: .
(2)若X、Y、Z的组成元素为同一短周期金属元素,且原子序数依次增大.X、Z最高价氧化物对应的水化物之间能发生反应.
①写出Y组成的元素原子结构示意图: ;
②写出X、Z最高价氧化物对应的水化物之间反应的离子方程式: ;
③列举一例Z在生活、生产中的用途: .
(1)若X、Y、Z的组成元素为不同短周期非金属元素.常温下,X为淡黄色固体,X在Z中充分燃烧可生成B,B是形成酸雨的主要物质之一,A与B反应生成固体X和C,C在常温下为无色液体.
①写出A的化学式:
②写出氢氧化钠溶液中通入少量的B反应的化学方程式:
③在298K、101kPa时,已知:
A(g)+
| 1 |
| 2 |
A(g)+
| 3 |
| 2 |
写出反应X+Z→B的热化学方程式:
(2)若X、Y、Z的组成元素为同一短周期金属元素,且原子序数依次增大.X、Z最高价氧化物对应的水化物之间能发生反应.
①写出Y组成的元素原子结构示意图:
②写出X、Z最高价氧化物对应的水化物之间反应的离子方程式:
③列举一例Z在生活、生产中的用途:
分析:(1)若X、Y、Z的组成元素为不同短周期非金属元素.常温下,X为淡黄色固体,X在Z中充分燃烧可生成B,B是形成酸雨的主要物质之一,则X为硫、Z为氧气、B为SO2,A与B反应生成固体X和C,C在常温下为无色液体,C为水,应是硫化氢与二氧化硫反应生成硫与水,据此解答;
(2)若X、Y、Z的组成元素为同一短周期金属元素,且原子序数依次增大.X、Z最高价氧化物对应的水化物之间能发生反应,应是氢氧化钠与氢氧化铝反应,故X为Na、Y为Mg、Z为Al,据此解答.
(2)若X、Y、Z的组成元素为同一短周期金属元素,且原子序数依次增大.X、Z最高价氧化物对应的水化物之间能发生反应,应是氢氧化钠与氢氧化铝反应,故X为Na、Y为Mg、Z为Al,据此解答.
解答:解:(1)若X、Y、Z的组成元素为不同短周期非金属元素.常温下,X为淡黄色固体,X在Z中充分燃烧可生成B,B是形成酸雨的主要物质之一,则X为硫、Z为氧气、B为SO2,A与B反应生成固体X和C,C在常温下为无色液体,C为水,应是硫化氢与二氧化硫反应生成硫与水,
①由上述分析可知,A为H2S,故答案为:H2S;
②氢氧化钠溶液通入少量二氧化硫反应生成亚硫酸钠与水,反应方程式为:SO2+2NaOH═Na2SO3+H2O,故答案为:SO2+2NaOH═Na2SO3+H2O;
③已知:Ⅰ、H2S(g)+
(g)═H2O(l)+S(s);△H1=-288.93kJ?mol-1
Ⅱ、H2S(g)+
O2(g)═H2O(l)+SO2(g);△H2=-586.16kJ?mol-1
根据盖斯定律,Ⅱ-Ⅰ得S(s)+O2(g)═SO2(g);△H=-297.23kJ/mol,
故答案为:S(s)+O2(g)═SO2(g);△H=-297.23kJ/mol;
(2)若X、Y、Z的组成元素为同一短周期金属元素,且原子序数依次增大.X、Z最高价氧化物对应的水化物之间能发生反应,应是氢氧化钠与氢氧化铝反应,故X为Na、Y为Mg、Z为Al,
①Mg元素原子,核外电子数为12,原子结构示意图为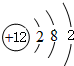 ,故答案为:
,故答案为: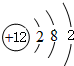 ;
;
②氢氧化钠与氢氧化铝反应生成偏铝酸钠与水,反应离子方程式为:Al(OH)3+OH-═AlO2-+2H2O,故答案为:Al(OH)3+OH-═AlO2-+2H2O;
③金属铝可以制造铝合金(铝热剂或包装业或导线或炊具等),故答案为:制造铝合金(铝热剂或包装业或导线或炊具等).
①由上述分析可知,A为H2S,故答案为:H2S;
②氢氧化钠溶液通入少量二氧化硫反应生成亚硫酸钠与水,反应方程式为:SO2+2NaOH═Na2SO3+H2O,故答案为:SO2+2NaOH═Na2SO3+H2O;
③已知:Ⅰ、H2S(g)+
| 1 |
| 2 |
Ⅱ、H2S(g)+
| 3 |
| 2 |
根据盖斯定律,Ⅱ-Ⅰ得S(s)+O2(g)═SO2(g);△H=-297.23kJ/mol,
故答案为:S(s)+O2(g)═SO2(g);△H=-297.23kJ/mol;
(2)若X、Y、Z的组成元素为同一短周期金属元素,且原子序数依次增大.X、Z最高价氧化物对应的水化物之间能发生反应,应是氢氧化钠与氢氧化铝反应,故X为Na、Y为Mg、Z为Al,
①Mg元素原子,核外电子数为12,原子结构示意图为
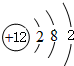 ,故答案为:
,故答案为: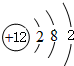 ;
;②氢氧化钠与氢氧化铝反应生成偏铝酸钠与水,反应离子方程式为:Al(OH)3+OH-═AlO2-+2H2O,故答案为:Al(OH)3+OH-═AlO2-+2H2O;
③金属铝可以制造铝合金(铝热剂或包装业或导线或炊具等),故答案为:制造铝合金(铝热剂或包装业或导线或炊具等).
点评:本题考查无机物的推断、热化学方程式等化学用语、元素化合物性质等,难度不大,掌握应为化合物的性质是关键.

练习册系列答案
 阶梯计算系列答案
阶梯计算系列答案
相关题目
 (2013?焦作一模)X、Y、Z是三种常见的单质,甲、乙是两种常见的化合物.下表所列各组物质中,物质之间通过一步反应不能实现如图所示转化的是( )
(2013?焦作一模)X、Y、Z是三种常见的单质,甲、乙是两种常见的化合物.下表所列各组物质中,物质之间通过一步反应不能实现如图所示转化的是( )  (2009?南京二模)X、Y、Z是三种常见元素的单质,甲、乙是两种常见的化合物,这些单质和化合物之间存在如图所示的转化关系,下列说法正确的是( )
(2009?南京二模)X、Y、Z是三种常见元素的单质,甲、乙是两种常见的化合物,这些单质和化合物之间存在如图所示的转化关系,下列说法正确的是( )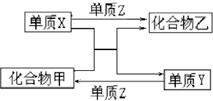 X、Y、Z是三种常见的单质,甲、乙是两种常见的化合物.下表各组物质之间通过一步反应不能实现如图所示转化的是(依次为X、Y、Z、甲、乙)( )
X、Y、Z是三种常见的单质,甲、乙是两种常见的化合物.下表各组物质之间通过一步反应不能实现如图所示转化的是(依次为X、Y、Z、甲、乙)( ) X、Y、Z是三种常见元素的单质,甲、乙是两种常见的化合物,这些单质和化合物之间存在如图所示的关系.下列关于X、Y、Z三种单质的说法一定正确的是( )
X、Y、Z是三种常见元素的单质,甲、乙是两种常见的化合物,这些单质和化合物之间存在如图所示的关系.下列关于X、Y、Z三种单质的说法一定正确的是( )