网址:http://m.1010jiajiao.com/timu3_id_192494[举报]
研究物质结构是为更好的掌握物质的性质.
(1)第四周期过渡元素在性质上存在一些特殊性,在前沿科技中应用广泛.
①铜为第四周期过渡元素,其基态原子电子排布式为
②金属镍粉在CO气流中轻微加热,生成液态Ni(CO)4分子.423K时,Ni(CO)4分解为Ni和CO,从而制得高纯度的Ni粉.试推测Ni(CO)4易溶于下列
a.水 b.四氯化碳 c.苯 d.硫酸镍溶液
③在硫酸铜溶液中通入过量的氨气,小心蒸发,最终得到深蓝色的[Cu(NH3)4]SO4晶体,晶体中含有的化学键除普通共价键外,还有
(2)已知:下表是14种元素的电负性的数值(用X表示).
| 元素 | Al | B | Be | C | Cl | F | Li |
| X | 1.5 | 2.0 | 1.5 | 2.5 | 2.8 | 4.0 | 1.0 |
| 元素 | Mg | Na | O | P | S | Si | Fe |
| X | 1.2 | 0.9 | 3.5 | 2.1 | 2.5 | 1.7 | 1.8 |
②气态氯化铝通常以二聚分子形式存在,分子式为Al2Cl6,分子中所有原子均达到8电子稳定结构,则Al2Cl6的结构式为


③由表中两种元素形成的化合物中,分子中既含有σ键又含有π键,且二者数目相同的有(写一个即可)
 化学选做题----物质结构
化学选做题----物质结构铜是过渡元素.化合物中,铜常呈现+1价或+2价.
(1)写出Cu+的电子排布式
(2)如图为某铜矿晶体结构单元,该铜矿的化学式
(3)已知,铜的第一电离能为746kJ?mol-1,第二电离能为1958kJ?mol-1.请结合核外电子排布相关知识解释,铜第二电离能远远大于第一电离能的原因
(4)对于CuX(X为卤素)而言,铜与X形成的化学键极性越强,对应的CuX的溶解度越大.据此可知,CuCl的溶解度比CuI的溶解度
(5)CO、NH3都能提供孤电子对与Cu+形成配合物.Cu+与NH3形成的配合物可表示为[Cu(NH3) n]+.该配合物中,Cu+的4s轨道及4p轨道通过sp杂化接受NH3提供的孤电子对.
①[Cu(NH3)n]+中n=
②[Cu(NH3)n]+中Cu+与n个氮原子构成的空间结构呈
③[Cu(NH3) n]+溶液可用于吸收合成氨原料气中的CO,加热吸收CO后的溶液又将放出CO.加热分解放出CO的过程中,必须克服微粒间的作用力是
已知A、B、C、D、E、F、G位于元素周期表的前四周期,且元素原子序数依次增加,A焰色反应呈黄色;工业常用电解B的熔融的氯化物来制备B,C是一种能被HF和NaOH溶液溶解的单质,D的电负性比磷大,第一电离能却比磷小,E单质是制备漂白液的原料,F能形成红色(或砖红色)和黑色的两种氧化物,G是一种主族金属.
(1)前四周期所有元素中,基态原子中未成对电子与其所在周期数相同的元素有
(2)元素A、B、C分别与氟气化合形成物质X、Y、Z熔点见下表:
| 氟化物 | X | Y | Z |
| 熔点/K | 1266 | 1534 | 183 |
(3)已知常温条件下,极性分子DOE2是一种液态化合物,中心原子D的杂化方式是
(4)G与氮原子可1:1化合,形成人工合成的新型半导体材料,其晶体结构与单晶硅相似.G原子的价电子排布式为
(5)F晶体的堆积方式是
已知元素A、B、C、D、E、F均属前四周期且原子序数依次增大, 其中A含有3个能级,且每个能级所含的电子数相同,C的基态原子2p轨道有2个未成对电子;C与D形成的化合物中C显正化合价;E的M层电子数是N层电子数的4倍,F除最外层原子轨道处于半充满状态,其余能层均充满电子,请回答下列问题:
(1)元素A、B、C的第一电离能由小到大的是_______(用元素符号表示)。
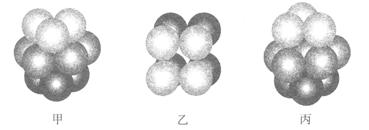
(2)F原子的外围电子排布式为_______,F的晶体中原子的堆积方式是下图中的_______(填写“甲”、“乙”或“丙”)。
(3)B与C形成的四原子阴离子的立体构型为 ,其中B原子的杂化类型是 。
(4)任写一种与AB-离子互为等电子体的离子 。
(5)F(OH)2难溶于水,易溶于氨水,写出其溶于氨水的离子方程式 。
(6)D和E形成的化合物的晶胞结构如图,其化学式为 ,
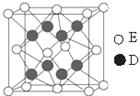
已知晶体的密度为
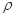 g·cm-3,阿伏加德罗常数为NA,
g·cm-3,阿伏加德罗常数为NA,则晶胞边长a= cm。(用
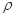 、NA的计算式表示)
、NA的计算式表示)(7)A、B、C三种元素和氢元素形成的氰酸有两种结构,一种分子
内含有叁键,称为氰酸,另一种分子内不含叁键,称为异氰酸,
且两种结构中所有原子最外层均已达到稳定结构,分子中也不含环状结构。请分别写
出氰酸和异氰酸的结构式:_______________、______________。
(1)化学式为Pt(NH3)2Cl2的化合物有两种异构体,其中一种异构体易溶于水,则此种化合物是________(填“极性”、“非极性”)分子.
(2)今有A、B、C、D四种元素,它们的原子序数依次增大,且均小于18,A和B在同一周期,A原子p能级有一个空轨道,B原子的p能级有两个未成对电子,0.1 mol C单质能从酸中置换出2.24 L氢气(标准状态),此时它就变成与B离子电子层排布完全相同的离子.D离子的半径在B、C、D中为最小.则:
①A是________,B是________,C是________,D是________.(填名称)
②A单质和B单质充分反应生成的化合物的电子式是________.
③我国科学工作者于20世纪90年代在兰州制备出过去一直依赖进口,价格十分昂贵的B的一种同位素形成的单质,1 mol这种单质中含中子的物质的量是20 mol,则这种同位素原子的符号为________.
(3)NH3·H2O的电离方程式为NH3·H2O![]() NH4++OH-,试判断溶于水后,形成的合理结构是________.(填下图中的字母)
NH4++OH-,试判断溶于水后,形成的合理结构是________.(填下图中的字母)

(4)把CoCl2溶于水后加氨水直到先生成的Co(OH)2沉淀又溶解后,再加氨水,使生成[Co(NH3)6]2+,此时向溶液中通入空气,得到的产物中有一种其组成可用CoCl3·5NH3表示,Co的配位数是6.把分离出的CoCl3·5NH3溶于水后立即加硝酸银溶液,则析出AgCl沉淀.经测定,每1 mol CoCl3·5NH3只生成2 mol AgCl.CoCl3·5NH3中Co化合价为________,请写出表示此配合物结构的化学式:________.
(5)核内中子数为N的R2+,质量数为A,则ng它的氧化物中所含质子的物质的量是________.
(6)Mg晶体的熔点比Na晶体________(填“高”或“低”),原因是________.