题目内容
 化学选做题----物质结构
化学选做题----物质结构铜是过渡元素.化合物中,铜常呈现+1价或+2价.
(1)写出Cu+的电子排布式
1s22s22p63s23p63d10
1s22s22p63s23p63d10
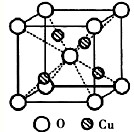
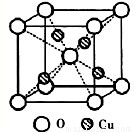
.(2)如图为某铜矿晶体结构单元,该铜矿的化学式
Cu2O
Cu2O
.(3)已知,铜的第一电离能为746kJ?mol-1,第二电离能为1958kJ?mol-1.请结合核外电子排布相关知识解释,铜第二电离能远远大于第一电离能的原因
Cu+中的3d轨道处于全充满状态,较稳定
Cu+中的3d轨道处于全充满状态,较稳定
(4)对于CuX(X为卤素)而言,铜与X形成的化学键极性越强,对应的CuX的溶解度越大.据此可知,CuCl的溶解度比CuI的溶解度
大
大
(填“大”或“小”).(5)CO、NH3都能提供孤电子对与Cu+形成配合物.Cu+与NH3形成的配合物可表示为[Cu(NH3) n]+.该配合物中,Cu+的4s轨道及4p轨道通过sp杂化接受NH3提供的孤电子对.
①[Cu(NH3)n]+中n=
2
2
;②[Cu(NH3)n]+中Cu+与n个氮原子构成的空间结构呈
直线
直线
型.③[Cu(NH3) n]+溶液可用于吸收合成氨原料气中的CO,加热吸收CO后的溶液又将放出CO.加热分解放出CO的过程中,必须克服微粒间的作用力是
配位键
配位键
.分析:(1)根据能量最低原理和洪特规则书写电子排布式;
(2)利用均摊法计算晶胞;
(3)失去1个电子后,Cu+处于稳定状态,第二电离能较大;
(4)根据Cl与I元素的非金属性强弱比较;
(5)Cu+有2个空的sp杂化轨道,NH3分子中的N原子有一孤电子对,进入Cu+空的sp杂化轨道,以配位键形成直线形结构.
(2)利用均摊法计算晶胞;
(3)失去1个电子后,Cu+处于稳定状态,第二电离能较大;
(4)根据Cl与I元素的非金属性强弱比较;
(5)Cu+有2个空的sp杂化轨道,NH3分子中的N原子有一孤电子对,进入Cu+空的sp杂化轨道,以配位键形成直线形结构.
解答:解:(1)Cu的电子排布式为1s22s22p63s23p63d104s1,失去一个电子后生成Cu+,其电子排布式为1s22s22p63s23p63d10,
故答案为:1s22s22p63s23p63d10;
(2)根据晶胞结构可知,O位于顶点和体心,共有:8×
+1=2个,Cu位于体心,共4个,n(Cu):n(O)=2:1,所以化学式为Cu2O,故答案为:Cu2O;
(3)失去1个电子后,Cu+中的3d轨道处于全充满状态,处于稳定状态,第二电离能较大,
故答案为:Cu+中的3d轨道处于全充满状态,较稳定;
(4)Cl的非金属性比I大,铜与Cl形成的化学键极性更强,对应的CuCl的溶解度较大,故答案为:大;
(5)Cu+有2个空的sp杂化轨道,NH3分子中的N原子有一孤电子对,进入Cu+空的sp杂化轨道,以配位键形成直线形结构,则[Cu(NH3)n]+中Cu+与2个氮原子形成配位键,
故答案为:①2;②直线;③配位键.
故答案为:1s22s22p63s23p63d10;
(2)根据晶胞结构可知,O位于顶点和体心,共有:8×
| 1 |
| 8 |
(3)失去1个电子后,Cu+中的3d轨道处于全充满状态,处于稳定状态,第二电离能较大,
故答案为:Cu+中的3d轨道处于全充满状态,较稳定;
(4)Cl的非金属性比I大,铜与Cl形成的化学键极性更强,对应的CuCl的溶解度较大,故答案为:大;
(5)Cu+有2个空的sp杂化轨道,NH3分子中的N原子有一孤电子对,进入Cu+空的sp杂化轨道,以配位键形成直线形结构,则[Cu(NH3)n]+中Cu+与2个氮原子形成配位键,
故答案为:①2;②直线;③配位键.
点评:本题考查较为综合,涉及电子排布式、晶胞计算、电离能以及配合物知识,题目难度中等,本题中易错点为(5),注意配合物的分析和积累.

练习册系列答案
相关题目

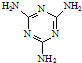 )俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸(
)俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸( 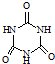 )后,三聚氰酸与三聚氰胺分子相互之间通过
)后,三聚氰酸与三聚氰胺分子相互之间通过